Cella krioprezerváció
Cél: megfontolni a sejtkultúra tárolási módszereit, a növényi sejtek krioprezervációjának előnyeit, a főbb szakaszokat, valamint a növényi sejtek jellemzőivel kapcsolatos nehézségeket.
1. Sejt növekedési retardáció
2. A krioprezerváció főbb szakaszai
2.1. A tenyésztés előkészítése
Fagyasztás és tárolás
2.3. A krioprotektáns megolvadása és eltávolítása
2.4. A sejtek rekultivációja és azok krioprezerváció utáni értékelésük
1 Jelenleg az új növényfajták és rendszeres változás, ami annak köszönhető, elsősorban a veszteség különböző tünetek, az új segg-lyatsy kártevők és betegségek, a klímaváltozás, SMO-ön és a különféle egyéb okok miatt. A búza és egyéb szemek átlagos élettartama általában 5-10 év. Az új fajták előállítása és a régiek javítása sokféle genetikai anyagot igényel. A ritka és veszélyeztetett fajok génállományának megőrzése érdekében értékes tenyésztési tárgyakat és gazdaságilag fontos anyagokat termelő törzseket fejlesztenek ki, in vitro gyűjtemények és bankok létrehozására szolgáló módszereket fejlesztenek ki.
A gének fő forrása a mag. Új sejtvonalak létrehozása. értékes termékek szintetizálásához szükséges, hogy tároljon egy sejtgyűjteményt, azaz olyan termelőcellák szabványait, amelyek bizonyos tulajdonságokkal rendelkeznek. A tenyésztett sejtekben élettani és biokémiai folyamatok tanulmányozásához szükségessé válik az eredeti standard sejtvonalak hosszú ideig történő megőrzése. Így a problémák megoldásához a sejtkultúra tárolására szolgáló eljárásokra van szükség. A probléma megoldására két megközelítés van: a sejtek növekedésének lelassítása és fagyasztott állapotban történő tárolás, vagyis a kriogó-megőrzés (görög khyos - "frost", "jég"). A kihívás a kultúra növekedésének kinetikájának megváltoztatása és a transzplantációk közötti idő növelése. Ez lehetővé tenné a növények 3-4 havonta, egy év alatt és még ritkábban történő átültetését. Jelenleg a növekedést korlátozó tényezők miatt növekedési lassulást csak a hajtások és a regeneráló növények esetében értek el.
A növekedés lassításának leghatékonyabb módja a termesztés hőmérsékletének csökkentése a csökkent megvilágítással együtt. A hőmérséklet megválasztását a növényfaj hideg ellenállása határozza meg. Így a burgonya gyűjtemények gyűjtésére 10 ° C-os hőmérsékletet és almafákat alkalmaztak 1 ° C-os hőmérsékleten. A 20-25 ° C hőmérsékleten általában növekvő tenyészeteknél 4-10 ° C-os hőmérsékleten ajánlott.
A növények növekedését is lelassítjuk az adagolást, hogy a tápanyag CFE de osmotikov - mannit és szorbit, szacharóz koncentrációja megnövekedett vagy bevezetése a táptalajba anyagok, amelyek gátolják a növekedést. Utóbbiaként maleinsav hidrazidot, borostyánkősav 2,2-metilhidrazidot, klór-kolin-kloridot, abszciensavat használunk. Nagyon ritka esetekben az oxigéntartalom-hipoxia csökkentése a növekedés lassítására szolgál. A hipoxiás állapotok 90% nitrogén és 10% oxigén keverék alkalmazásával jönnek létre. Néha csökken az oxigén koncentrációja, ugyanakkor csökken a légköri nyomás. A tápanyagok kimerülése és a kiszáradás elkerülése érdekében a lassan növekvő tenyészetek agar táptalajának térfogata nő. Ha folyékony táptalajt használunk, időről időre kiegészítjük, mivel aktívabban elpárolog.
2 A krioprezerválás mélyfagyasztás és tárolás rendkívül alacsony hőmérsékleten, például folyékony nitrogénhőmérsékleten (-196 ° C). Egy ilyen hőmérséklet biztosítja a tárgyak genetikai jellemzőinek stabil megőrzését gyakorlatilag bármely időszakra. Ez a módszer lehetővé teszi a legkülönbözőbb anyagok tárolását - az elszigetelt protoplasztoktól az embriókig és a magokig. Jelenleg a sejtek, szövetek és szervek mélyfagyasztása széles körben elterjedt az orvostudományban és az állattenyésztésben. A helyzet eltér a növényi anyagtól. A főbb nehézségek a növényi sejtek sajátosságával és a mélyfagyasztás folyamatával kapcsolatosak. A nagy, nagy vacuolák és sok víz növekszik, amikor fagyasztják és később felengedik. A sejtkárosodás a jég képződéséhez kapcsolódik mind a sejtek, mind az ajtókon kívül. A jég általában először a sejtek körül külső megoldásként alakul ki. citoplazmájában fagyáspontja mínusz 1 ° C, de a sejtek nem adagolására-zshimi körülbelül 10-15 ° C, mert akár e plasmalemma további megakadályozza behatolását jégkristályok növekszik a külső oldattal. A sejten belüli jégkristályok növekedése elpusztítja membránjait.
Ha a hőmérséklet lassan csökken, a cella elveszíti a szabad vízből azt a részét, amely elhagyja azt, és a külső oldatban lassan növekvő kristályok felületén lefagy. A nagyon gyors fagyasztást nem kíséri a kiszáradás, és a jégkristályok megjelenését idézi elő a citoplazmában. A lassú fagyás teljesen kiküszöböli a sejtben a víz kristályosodását, de elkerülhetetlenül a protoplazmának jelentős kiszáradása és összenyomódása van. A sejtek kiszáradása a külső oldat koncentrációjának következtében jön létre. A túlzott plazma-lízis és az általa okozott ozmotikus stressz (különösen a későbbi deplasmolízissel) leadja a sejtet.
Így a fagyás alatt a sejtvesztés oka a sejt belsejében lévő jég képződése és a membránok mechanikai károsodása, valamint a sejt erős dehidrációja által okozott ozmotikus stressz. Következésképpen a krioprezervációban használt összes technika mindkét káros tényező bizonyos egyensúlyát célozza. A túlélés a növényi sejtek függ számos feltétel: gén-illetö és azok morfológiai és fiziológiai jellemzőket és a képesség, hogy holo-dovomu edzhetõség, összetétele és mennyisége természetes vagy mesterségesen hozzáadott krioprotektánsok, a szint a permeabilitása ezen anyagok és a víz hőmérséklete csökkentési sebessége és a felolvasztás feltételeket.
A sejttenyészet cryos tárolására irányuló munka a következő lépésekből áll (18. Ábra): - sejttenyészet előkészítése,
- folyékony nitrogénben történő tárolás,
- a növények rekultivációja és regenerálása.
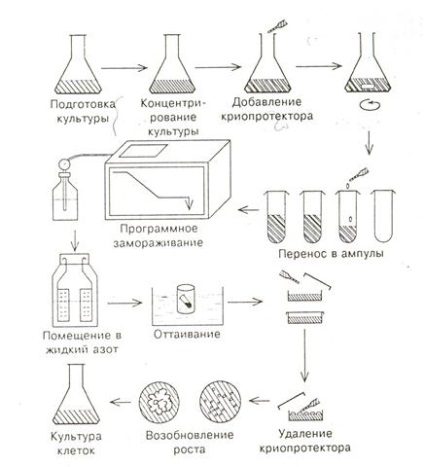
18. ábra. A sejttenyészet kriokonderválásának lépései
2.1 Tartsuk a sejtek krioprezervációjának főbb szakaszaira. Kísérletileg kimutatták a tenyésztett sejtek, az elszigetelt merisztémák, a hajtások, az embriók, a pollen legutolsó hőmérsékletének tárolási lehetőségeit. Az ilyen különböző tárgyak mélyhűtésére természetesen természetesen más megközelítések és feltételek szükségesek a munka kezdetétől. A szuszpenziós kultúrák számára a krioprezervációs módszerek a legfejlettebbek. A kis meristemoid sejtek jobban ellenállnak a fagyásnak, mint a nagy vacuolált sejtek. Ugyanez vonatkozik a finom diszpergált szuszpenziókra, amelyekben a sejtek laza aggregátuma van, szemben a nagy sűrű sejttömegekkel. A trópusi növényfajok sejtjei kevésbé rezisztensek lehetnek a mérsékelt zónában lévő növényi sejteknél. Bonyolultabb struktúrákhoz, például merisztémákhoz, embriókhoz, embriókhoz, az egyes szakaszok körülményeinek optimalizálására van szükség. Különös jelentőséggel bír a kultúra speciális előkészítése, amelynek célja merisztematikus sejtjeinek gazdagítása. Az osmotikumban a hosszantartó tenyésztés, a sejtosztódás szinkronizálása, a transzplantációs idő csökkentése elősegíti a sejtek méretének csökkentését és növeli azok túlélését. Az egyéni kultúrák esetében pozitív hatással van a
Az egyes aminosavakkal való termesztés, mivel az endogén cukrok szintje nőtt a sejtekben. A szuszpenziós tenyészetek esetében a koncentráció fontos előkészítő pillanat.
2.2 A krioprotezők olyan anyagok, amelyek csökkentik a fertőzés pontját, megköti az intracelluláris vizet, és védi a sejteket a mechanikai és az ozmotikus stressztől. Ezek közé tartoznak a dimetil-szulfoxid (DMSO), a glicerin, a prolin és a szacharóz, amely a növények természetes krioprotektívja. Maguk a krioprotektorok is okozhatnak ozmotikus stresszt, ezért optimalizálják azok optimális koncentrációit és kombinációit.
A DMSO egyedülálló áthatoló képességű, ez különösen fontos a nagy, sűrű, szervezett struktúrák, például a meteoritok számára. Számukra az előkészítési fázis elsősorban az 5% DMSO-t tartalmazó tápközeghez történő előtenyésztéshez szükséges. Ez biztosítja a hatékony krioprotektív koncentráció kialakulását a csúcs alatt, amelynek mérete körülbelül 0,3-0,5 mm.
A krioprotektánsok kiválasztásával együtt, és ezekhez a sejtekhez nagyon fontos az optimális fagyasztási program megtalálása. Lassú, fokozatosan fagyos, gyors és szupergyors három. Lassú fokozatos fagyasztással a 0 ° -tól -40 ° -ig terjedő hőmérséklet 0,5-1 ° perc sebességgel csökken. Gyorsan fagyasztva az ampullában lévő tárgyat a krioprotektánstól azonnal folyékony nitrogénbe merítjük. Az ultragyors fagyasztással az objektumot közvetlenül bevezetik folyékony nitrogénbe. A pollen száraz állapotban fagyasztható, speciális műanyag ampullákba zárva, folyékony nitrogénbe merítve. A moszkvai IGF krio bankjánál kapott adatok azt mutatják, hogy a programozási fagyás eredményesebb eredményeket hozott. Ehhez különleges kialakításokat igényelnek egy működő kamrával, amelyet programozott sebességgel hűtünk folyékony nitrogéngőz bevezetésével.
2.3 A növényi növekedés visszaszorítása és helyreállítása kritikus és gyakran a folyamat kritikus szakaszai. Ha a sejteket túlságosan lassan felengedik, akkor jeget formálnak, ami káros hatással jár. A gyors olvadás megakadályozza ezt. A felolvasztást úgy végezzük, hogy az ampullákat meleg fürdőben (+40 ° C), vagy meleg vízzel vagy tápközeggel fagyasztott tárgyakra csöpögünk. Kivételes esetekben azonban a lassú olvadás megfelelőbb.
Felolvasztás után a krioprotektánst eltávolítják, ami általában hidegben történik. A sejtek fizikai változásainak nagy része a fagyás és a felolvasztás során fordul elő, de az újonnan felolvasztott sejtek erősen hajlamosak a további károsodásra, ezért óvatos "ápolásra" van szükség. Ez a sejt közvetlen transzplantációjával kezdődik a helyreállító tápközeghez, anélkül, hogy a sejtek krioprotektánsainak megőrzésével lemosnánk. Gyakran előfordul, hogy a krioprotektánsokat speciális mosási körülmények között eltávolítják.
2.4 A növények állapotát nagyon nehéz megítélni, amikor az anyag fagyasztva marad. Az értékelés a felolvasztás után történik, és a növények felhasználásához szükséges. A növények gyors felmérésére a legalkalmasabb
életképességét. A teszteket kívánatosnak kell lenni nem közvetlenül a felolvasztás után, másnap pedig. A vizsgálatokat a növekedés folytatása során rendszeres időközönként hajtják végre, hogy megfigyeljék az életképes sejtek vagy élő szövetek tartalmának növekedését.
A transzmissziós fényben mikroszkóp alatt látható minták, azaz sejtszuszpenziók, protoplasztok, kicsi kallusz és szervezett szerkezetek, fluoreszcein-diacetáttal festődő feno-franint használnak. A tetrazolium sóit kalluszra és sűrű, nagy szervezett struktúrákra használják.
A túlélés kvantitatív értékelése a növekedés. A tenyésztett sejtek növekedését minden szokásos módszerrel tanulmányozzuk a növekedés mérésére, beleértve a nyers és száraz tömeg növekedését, a telepített sejtek térfogatát, a sejtek optikai sűrűségét, közvetlen mikroszkópos megfigyelést. A szabványos citológiai eljárások lehetővé teszik a szövetek károsodásának és helyreállítási folyamatainak felmérését. Az ultrastruktúrát elektronmikroszkópban vizsgálva még pontosabb adatokat kapunk.
A sejtkultúrák heterogenitásának, a fagyasztásra való előkészítésüknek köszönhetően lehetetlen kizárni a szelektív előnyök bármely szubpopulációban való megjelenésének lehetőségét, különösen a felengedés után alacsony túléléssel. Ezért genetikai, élettani és biokémiai vizsgálatokra van szükség.
A rekultiváció szakaszában a sejtnövekedés fokozódásának néha ismert módszereit használják a lehetséges mutáns hidegálló sejtek kiválasztásának elkerülésére. Megállapítást nyert, hogy a folyékony nitrogénben történő tárolás nem befolyásolja a sejtkultúrák túlélését és megújulását. A folyékony nitrogénben történő tárolás után visszanyert sejtkultúrák megegyeznek az eredetiekkel, és alkalmasak biotechnológiai alkalmazásokra.
Így a sejtek, a merisztémák, a virágporok kriolitja biztosítja nemcsak a termesztett in vitro termelő törzsek génállományának megőrzését, hanem ritka és veszélyeztetett fajokat is, ami különösen fontos a vegetatívan szaporított növények számára.
1. A génállomány megőrzésének módszerei in vitro.
2. Mi az előnye a sejtek krioprezervációjának?
3. Mi a krioprotektáns?
4. A sejtek előállítása a krioprezervációhoz.
5. Hogyan fagynak be és felengedik a sejteket?
A használt irodalomjegyzék
5. Kalinin F.L. Sarnatskaya V.V. Polishchuk V.V. A kultúra módszerei
szövetek és sejtek a növények fiziológiájába és biokémiájába. -Kyiv: Naukova Dumka,
1980.
6. Valikhanova G.Zh. Rakhimbaev I.R. Karzhasova A.V. Bishimbayeva N.K.
Módszertani útmutató a szövettenyészet gyakorlati leckéire
növények. -Alma-Ata: KazGU, 1983.
7. Kataeva P.V. Butenko R.G. A növények klonális mikropropágációja.
M. Nauka, 1983.
8.Gleba Yu.Yu. Sytin a KM-be Celluláris növénygyártás. -Kiev:
Naukova Dumka, 1984.
9.Butenko R.G. A növényi sejtek és a biotechnológia kultúrája. -M: Tudomány,
1986.
10. Cellular Engineering / Butenko RG Gusev MB. Kirkin A.F.
Biotechnology, T. 3.-M .; Középiskola, 1987.
11. Növényi biotechnológia: sejttenyészet. - M;
Agropromizdat, 1989.
Mamyrbekova Aigul Kumekbaevna, Abubakirova Azhar Abdugapparovna