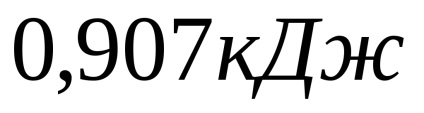Laboratóriumi munka №3м
Laboratóriumi munka 3. A semlegesítési reakció termikus hatása
A munka célja. A kalorimetrikus mérések módszerének elsajátítása; meghatározza a kénsav és az alkáli semlegesítési reakció termikus hatását; a termokémiai számítások elsajátítása.
A kémiai folyamat. A kénsav semlegesíthető két módon. Az első módszer a szekvenciális semlegesítés két szakaszban.
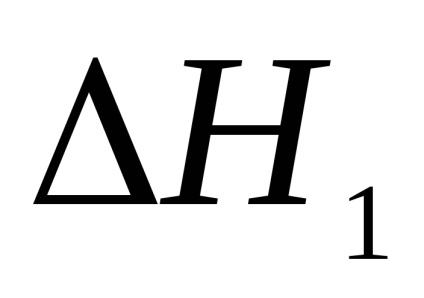
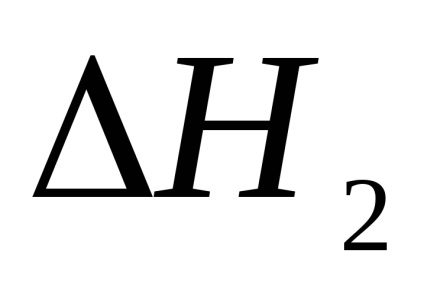
A második módszer a kénsav teljes semlegesítése egy szakaszban.
Figyelembe kell venni, hogy a kénsav gyenge sav a Kdis = 1.2 · 10-2 disszociáció második szakaszában.
Kísérleti rész. A reakció termikus hatásának meghatározását egy kalorimetrikus készülékkel végeztük. A legegyszerűbbek a 2. ábrán láthatók.
Tapasztalat 1. Kénsav semlegesítése két lépésben.
A
2. kísérlet. Kénsav semlegesítése egy szakaszban.
Egy 50 cm3 1M kénsavoldatot kalorimetrikus főzőpohárba öntöttünk. Megmértem a hőmérsékletet (t1). A palackot 50 cm3 2 mólos nátrium-hidroxid-oldattal töltöttük. Gyorsan és veszteség nélkül a hengeres alkáli oldatból. A kapott Na2S04 átlagos sót oldattal rázzuk. Megmértem a maximális hőmérsékletet (t2). A kísérlet eredményeit az 1. táblázat tartalmazza.
tapasztalat I (1,2) tapasztalat II (3)
A tapasztalatok feldolgozása
A semlegesítési reakció eredményeként felszabaduló hőt a képlet szerint számítjuk ki
,

ahol
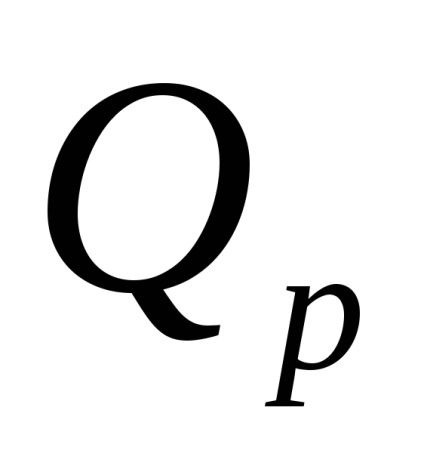




10 -3 - J konverziós tényező kJ-ban.
A kezelt betegnek hatásos fajhője a megoldás annak a ténynek köszönhető, hogy a reakció-hő semlegesítés fogyasztják nem csak fűtésre a megoldás, hanem a falak melegítése, belsejében a koloriméter (üveg csésze), ahol a súlya ez a rész a rendszer szigorúan véve nem ismert, hogy a hő egy hőmérő, a víz párolgása az oldat hőmérsékletének növekedésével stb. Mivel a viszonylag kis mennyiségű savak vagy bázisok Ezek a tényezők jelentősen, és figyelembe veszik a ez a hatás kerül bevezetésre az úgynevezett „állandó kaloriméter”, ami esetünkben helyébe a hatékony hőkapacitása a folyadékok.
1. Az első kísérletben kiszámítottuk a semlegesítési reakció első és második szakaszának hőhatását.
2. Számolja ki a második kísérletben a semlegesítési reakció termikus hatását.
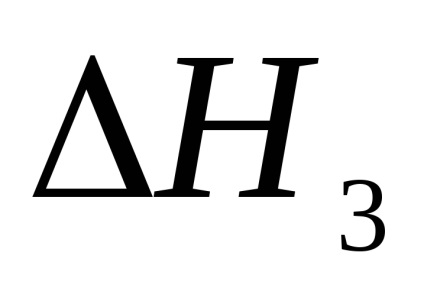
3. A törvény hatása alapján Hess kiszámította a kénsav és az alkáli reakció semlegesítésének elméleti hőhatását, a reakciótermékek és a kiindulási anyagok képződésének ismert hőtermelésével, amelyeket a 2. táblázatban adtunk meg.


Mivel mindkét kísérletben a termikus hatások különbsége elhanyagolható, arra a következtetésre juthatunk, hogy a Hess törvény következménye teljesül.
Következtetés: Ennek során a laboratóriumi munka, azt elsajátította a technika kalorimetriás méréseket készített termokémiai számítások határoztuk termikus hatása semlegesítési reakció kénsav lúggal két módon. Az első kísérletben a hőhatás egyenlő volt; a második kísérletben -; az elméleti hőhatás 31,82kJ volt. Megerősítette a Hess törvényének vizsgálatát. Az első kísérlet relatív hibája 2,85%, a második 7,41% -ában; az első kísérlet abszolút hibája -