Vas és vegyületei
Célkitűzések. Hogy bevezessük a vas pozícióját a periódusos rendszer a kémiai elemek Mendeleev, atomi szerkezete, természetes betétek, vegyületek modern előállítási módszerek, tulajdonságai és felhasználása a vas. Fejlődésének elősegítése a tanulók csapatmunka készségeket, elvtársi kölcsönös segítségnyújtás.
Felszerelés és reagensek. Csövek a nagyolvasztó termelési táblázat; HCl-oldattal és H2 SO4. porok a Fe (OH) 2 és Fe (OH) 3. vasreszelék, oldatok ferrocianid só K4 [Fe (CN) 6], és a vörösvérsejtek sók K3 [Fe (CN) 6].
Típusa leckét. Elemei előadások, történet, beszélgetés.

- magnetit Fe3 O4- tartalmaz 72% vasat, a magnetit találhatók lerakódások a South Ural Kurszk mágneses anomália;

Regenerálást úgy végezzük el hőmérsékleten 850-900 ° C, ami alatt van az olvadáspontja vas (1539-ben ° C).
Sok modern gépek ágazat esetében nagyon magas a vas tisztaságú. Ezután a tisztítást végzünk műszaki vas karbonil módszerrel. Karbonilek - egy fém vegyületet szén-monoxiddal (II) CO. Vas reagál CO megemelt nyomáson és hőmérsékleten 100-200 ° C, képző vas-pentakarbonilt:
Vas-pentakarbonilt - folyékony anyag, amely könnyen elkülöníthető a szennyezéseket desztillációval. A hőmérséklet körülbelül 250 ° C-karbonil bomlik könnyen alkotnak vaspor:
Ha a kapott por vetettük alá szinterezés vákuumban, a kapott fémtartalmú 99,98-99,999% vasat. Miért van szükség, így a fém tisztaságát?
Student. nagy tisztaságú vas kell először tanulni annak tulajdonságait, azaz a A tudományos célokra. Ha nem tudja megszerezni a tiszta vas, akkor nem tudom, hogy - puha, könnyen kezelhető fém. Vegytiszta vas sokkal közömbös, mint a vas karbantartás. Fontos ágazat a használata a tiszta vas speciális ferroötvezetgyártáshoz termelés tulajdonságai romlanak a szennyeződések jelenléte.
Tanár. Melyek a kémiai tulajdonságai a vas?
Student. Kémiai tulajdonságait vas miatt a szerkezet a elektronhéjak annak atomok. Vas - eleme az átmeneti csoport VIII 4. csoport hosszú ideig. Vas kifejezés d-elemek, atomok képletű E-nek a vége ... 3d 6 4s 2. A vasvegyületek oxidációs állapotban mutat +2 és +3. A legnagyobb fokú +6 oxidációs a vas. Ez nyilvánul meg a ferrata - vassók megszűnt savat. Például, Na2 FeO4- nátrium-ferrát.
Tanár. Mivel a vas reakcióba lép az oxigénnel?
Student. Az elektrokémiai sorban feszültségek vas marad hidrogén, T. E. Van egy negatívabb standardpotenciál. Ezért, a vas könnyen oldódik hígított sósav vagy kénsav és a hidrogén-fejlődés:
További koncentrált kénsavat (40-60%), hogy a vas helyreállítja
kén-oxid (IV):
A kénsav koncentrációja nagyobb (80 és 100%) zhelezopassiviruetsya - és borított vékony szilárd oxid film, amely megvédi a fémet a oldás. Ugyanez a jelenség a passziváló fordul elő erősen koncentrált salétromsavat, így tömény kénsav és salétromsav lehet szállítani egy vas tartályban.
Híg salétromsavval reakcióba léphet vas alkotnak vassó (II), de egy töményebb oldat sav - só vas (III) sav és a különböző helyreállítási termékek, például:
Tanár. Ne felejtsük el, az úgynevezett korróziót. Mik a hatásai?
Student. Korrózió - egy megsemmisítése a fém az intézkedés alapján a környezet. Rust leírható az alábbiak szerint:
Rust lefejtjük a fém felületén van egy csomó pórusokat, így nem védi a fémet a további korróziótól. Mivel a korrózió meghal hatalmas mennyiségű vas és ötvözetei. A XIX. amikor nem volt megbízható módszerek korrózió csökkentésére, belőle pusztult felében olvadt fém. A mai viszonyok között a korrózió meghal 1/6 olvasztott nyersvas. Ezért korrózió - az egyik fő probléma az emberiség.
Tanár. Ne a amfoter vegyületek vas?
(A kérdés megválaszolására a tanár maga vagy előre elkészített, akik érdekeltek a kémia tanuló.)
.. vas-hidroxid (III) amfoteren, azaz tulajdonságokat mutat, egy bázis a reakciót sav:
és savas tulajdonságok reakciók tömény oldatok lúgok:
Amfoter jellegű, és így vas-oxid (III), amely reakcióba lép a savakkal, és az alapvető oxidok:
A Mester összpontosít a diákoknak, hogy vannak tipikus reakciók vegyületek két vegyértékű és három vegyértékű vas, kísérő történetét végzett kísérleteket.
Tanár. Kimutatására a ionok vas (III) komplex vegyületként a kényelmesen beadható vas nevezett ferrocianiddal sóját vagy ferrát (II) K4 kálium [Fe (CN) 6]. A reagáló ionok (Fe (CN) 6) 4-, hogy Fe3 + ionokkal képződik sötétkék csapadékot - Prussian blue:
Egyéb vas vegyületet - vörösvérsejtek sóját vagy ferrát (III) K3 Kálium [Fe (CN) 6] a reagens ionok Fe 2+.
A reagáló ionok (Fe (CN) 6) 3- Fe 2+ ionok is készített egy sötétkék csapadékot - turnbuleva Blue:
Sorolja fő felhasználási területe a vas. Ami fontos, az a természetes vas?
(A diákok válaszolni a kérdésekre, a tanár elmagyarázza a válaszokat.)
Az első diák. Ferrates különböző fémeket használnak a modern elektronikai ipar és az automatizálás.
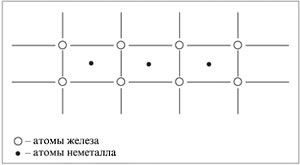
A második tanuló. Szokatlan formák a vegyületet vassal, hidrogén, nitrogén és szén. Az atomok ezek nemfémes vannak méretezve kevesebb vasat tartalmaz, és könnyen belefoglalhatjuk között a fém rács a csomópontok, alkotó szilárd oldatok.
A következő kérdések a diákoknak, hogy megszilárdítsa az anyagot vizsgálták.
1. Mi a helyzet a vas a periódusos kémiai elemek?
2. Mi az oxidációs állapotban lévő vas vegyületek mutatnak?
3. Melyik vas vegyületek amfoter tulajdonságokkal?
4. Mivel a vas reagál salétromsavval és kénsavval, különböző koncentrációjú?
5. Hogyan lehet megkülönböztetni a vegyületek és ferri?
6. Mi a haszna és értéke vas vegyületek a jelenlegi szakaszban az emberi fejlődés?
Ha az idő engedi, akkor rögzítse a figyelembe vett anyagok vas, az alábbi kérdésekre.
1. Mi az előnye a közvetlen előállítási eljárása vasat?
2. Miért hasznos érc dúsítás?
3. Hogyan kell gazdagítani az érc flotációs?
4. Mi az alapvető értelme a technikai vas karbonil tisztítási módszer?