A téma a termikus hatás
§ 1. Elméleti ismeretek a termikus hatás. Alapfogalmak A termodinamika. Standard képződési entalpia. Törvények Termokémia ........................................ .......... ....... ......................... .... ... .page. 4
2.§ Kísérleti meghatározás hőhatásról ........................... .. ... ..str. 10
3. § A használata a termikus hatás a gyakorlatban. Vegyi „melegebb”, és hideg csomag. Hőálló bevonatok. A termokémiai kezelési módszer a gyémánt .................................................................................................... o.
Mint tudjuk, a földi élet nélkül lehetetlen kémiai reakciókat. Ők alkotják az alapját a létrehozását és működését a legtöbb modern tárgyak. Anélkül, kémiai reakciók, a bolygónk sem az ózonréteg védelme, a föld gyomrában nem lenne rejtett ásványi anyagokat. Ezért, a kémiai reakciók - az egyik legfontosabb dolog a világon, és a tanulmány közülük - egy nehéz, de nagyon hálás folyamatot.
De ahhoz, hogy elérjük a lényege a kémiai reakciókat egyetlen előadás lehetetlen. Csak akkor tudjuk leírni néhány saját oldalán. Ezért választottam a témája a kutatás talán az egyik legérdekesebb és minden bizonnyal az egyik legfontosabb szempont a kémiai reakciók - a termikus hatás.
Hőhatás kémiai reakciók szükséges sok mérnöki számítások. Úgy találják, széles körű alkalmazását számos iparágban, valamint a katonai fejlesztések. A tudás a termikus hatás is fontos, hogy megoldja számos gyakorlati problémát. Kémiai reakciók a hő a gáz ég a lakások, van meleg víz, villany van, mivel az ilyen típusú kémiai reakció meghajtó autóinkat, repülőgépet és rakéták. Minden égési reakció - a lényege a hő reakció. Puskapor, lőfegyverek, vágó és hegesztő fémek, ipari lézereket ... A kémiai reakciók mindenhol.
Más szóval, a kémiai reakciók c termikus hatása része a modern emberi élet és a társadalom. Ez azért van, mert már szerves része az életünknek, és különös figyelmet kell fordítania erre a témára. Ezért ez a téma általunk választott, hogy írjon az esszé.
A tanulmány célja az - változatosabbá és fedezze fel a jelenség a termikus hatás és a lehetőséget, annak gyakorlati alkalmazását. Ezt a célt el lehet érni megoldásával számos feladatot minket:
1. Get bevezette a termodinamika és a fő szempontok;
2. Vizsgálja részén termodinamika úgynevezett termokémia;
3. Ahhoz, hogy megértsük, hogy az ilyen termikus hatás, és mi a jelentése a kémia;
4. Ismerje meg a különböző módon alkalmazzák a megszerzett tudást az életben.
§1. Elméleti ismeretek a termikus hatás.
Alapfogalmak A termodinamika.
Termodinamika (görögül. # 952; # 941; # 961; # 956; # 951; - „meleg” # 948; # 973; # 957; # 945; # 956; # 953; # 962; - „teljesítmény”) - egy ága alkalmazott fizika és az elméleti hőtechnikai, amely feltárja az átalakulás mozgás hővé és fordítva. A termodinamika, tekinthető nemcsak kérdéseket hőterjedés, de fizikai és kémiai változást kapcsolódó hő abszorpciós szer, és fordítva, közben keletkező hő a fizikai és kémiai átalakulások. [1]
Termodinamika történelmileg alakult ki, mint az empirikus (tapasztalati) Science fő módja konvertáló az energia belső szervek a mechanikai munka végzése céljából. Azonban a fejlesztési folyamat termodinamika behatolt minden ágát a fizika, ahol lehetőség van, hogy a koncepció a „hőmérséklet”, és lehetővé tette, hogy elméletileg megjósolni számos jelenség sokáig a szigorú elmélet ezeket a jelenségeket.
Kémiai termodinamika tanulmányok kölcsönös átalakítása hő és energia kémiai rendszerek és állapotát írja le a kémiai egyensúly. Ez azt jelzi, hogy milyen feltételek mellett lehet ez vagy az a reakció. [2]
Ebben a fejezetben megnézzük az alapvető termodinamikai törvények és a fogalmakat.
Termodinamikai átalakulások vannak kitéve az alapvető termodinamikai törvények - termodinamikai elveket. Összesen 3, plusz egy megjegyzés, más néven nulla főtétele.
A termodinamika első főtétele - a törvény az energiamegmaradás termodinamikai folyamatokat. Így hangzik:
Az energia származik és semmi nem tűnik el teljesen, csak átalakított egyik formából a másikba.
Az energia más. Ennek során a fizika foglalkozik ilyen fajta van, mint a potenciális és kinetikus. A kémiában fontos anyagok belső energia (mozgási energia a molekulák és atomok). A változás a belső energia az anyag a kémiai reakciók során sokkal nagyobb, mint a változás a kinetikus és potenciális energiája. Ezért a laboratóriumi kísérletekben, mi nem dobjuk ampulla anyagok nagyobb változások az energia (amit szükség reakció), és más módszerekkel. Része a belső energia társított a mozgás az elektronok atomok nevezzük kémiai energia.
Ezen túlmenően, a kémiai reakciók fontos tudni, hogy a hőenergia anyagokat. Az úgynevezett teljes energia az atomok és molekulák a molekula egészének. hőenergia olyan intézkedés a testhőmérséklet. Sőt, azt is függ a halmazállapot az anyag, és a típus a molekulák. Hőenergia szabadul fel, például akkor, amikor a kémiai energiát a kiindulási anyagok a kémiai reakció során nagyobb, mint az energia termék.
A törvény az energiamegmaradás kémiai reakciók, így szól:
A felszabaduló hőenergiát a kémiai reakció során a változás a kémiai energia.
A termodinamika második törvénye több különböző, de ugyanakkor egyenértékű készítmények.
1 - posztulálni Clausius [3]. A folyamat, amelyben nincs más változás, kivéve a hőátadást a forró a hideg test visszafordíthatatlan, hogy van, a hő nem tud menni, ha hideg meleg test változtatások nélkül a rendszerben. Ezt a jelenséget nevezzük diszperziós vagy energia eloszlatását.
2 - Kelvin feltételezik [4]. Egy eljárást alkalmazunk, amelyben a hő a folyamat továbblép változtatások nélkül a rendszerben, visszafordíthatatlan, azaz lehetetlen kapcsolja be a munkát az összes hőt vett a forrás egy egyenletes hőmérséklet, anélkül, hogy más változtatásokat a rendszerben.
Kémiai reakciók termikus hatás - az úgynevezett spontán folyamatok, azaz megy önmagukban. Az ilyen eljárások közé tartozik, és az exoterm és endoterm reakciók.
Azonban, miután egy sor kísérletekhez, azt találtuk, hogy vannak olyan tényezők, amelyek meghatározzák az irányt a spontán reakciókat.
Exoterm generált hő felmelegíti a reagensek, ezáltal meghosszabbítva a reakcióidő, sőt, tudjuk, hogy az energia a exoterm reakciók csökken. Így a kémiai reakció zajlik spontán lefelé anyagok energiát.
De sok a bomlási reakció (endoterm típus) is megy spontán, ez azt jelenti, az energiafelhasználás csökkentését - nem az egyetlen tényező.
[5]
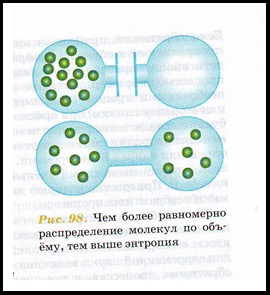
Entrópia (a görög. # 958; # 957; # 964; # 961; # 959; pi # 943; # 945; - forgás, transzformáció) - a tudomány - intézkedés a rendellenesség álló rendszer számos eleme.
Entrópia kijelölt S. jele
Rudolf Clausius először megalkotta a szót termodinamika 1865. A termodinamika, ez az intézkedés a visszafordíthatatlan energiaelosztás, az intézkedés a tényleges folyamata eltérés az ideális.
Minél több egyenletes eloszlását az összes tulajdonságait a rendszer (teljesítmény, nyomás, hőmérséklet, és így tovább. D.), annál nagyobb a entrópia. Az irány növekedése entrópia és előfordulhat az összes spontán folyamatok.
Ezért a termodinamika második törvénye egészének az alábbiak szerint történik:
Izolált rendszerek spontán folyamatok folytathatja csak a növekedés a entrópia. entrópia nem változik egy reverzibilis folyamat.
A harmadik főtétele: Nernst-tétel: Az entrópia olyan rendszer abszolút nulla hőmérséklet mindig nullának.
Van is egy megjegyzés, hogy a kezdet. vagy nulla főtétele.
Zero főtétele kimondja, hogy:
Minden egyes izolált termodinamikai rendszerben van egy termodinamikai egyensúlyban, amely rögzített környezeti körülmények között idővel spontán eléri.
A számítások a kémiai reakciók vegyészek fontos tudni, hogy ezek a törvények.
Termodinamika tartalmaz egy sor formulák, amelyek leírják az átalakítás az energia, a kémiai reakciók során, és ezek mind alá alaptörvényei beszéd, amelyek ebben a fejezetben.
Termikus hatása.
Nem történik kémiai reakció nélkül költségek vagy elengedése egy bizonyos mennyiségű energiát, illetve hőt. Ez azért van, mert minden egyes anyag kezdetben közölt egy bizonyos mennyiségű energiát. És a különböző anyagok száma eltérő.
A reakció során, a törés a kötések a kiindulási anyagok és a kialakulását új kötések a reakciótermékek. Mivel az oktatás a kapcsolat a kiadás, és szakítás - a energia elnyelését, a kémiai reakciók kísérik energia hatásokat.
Alapján a különbség a tárolt energia a kiindulási anyagok és a reakciótermékek két típusú reakciók.
Az első típus - reakciót hőfejlődés vagy exoterm (a görög exo -. Külsőleg) reakciót. Ez magában foglalja a reakcióban, amelyben az energiaellátás a kiindulási anyagok nagyobb, mint a tárolt energia a reakció termékek. Ebben az esetben az energia felszabadul a környezetbe, ezért szükséges, hogy gondoskodjon a hőelvezetést a túlmelegedés elkerülése érdekében, vagy robbanás egy kémiai reaktor.
Reakciókban, amelyekben a termékek egy nagyobb energiatartalmú, mint a kiindulási anyagok tartozik a második típusú - reakcióban hőabszorpcióval vagy endoterm (a görög endo -. Befelé). A endoterm reakciók, amelyek szükségesek a hő elnyelődik a környezettől, így laboratóriumokban ilyen reakciók lépnek fel hevítésre.
Ez az első alkalom a „exoterm” és „endoterm” lépett be a francia kémikus Pierre Berthelot [6]. tartják az egyik alapító termokémia [7].
Példák az exoterm reakciók lehet egy égési reakció. Például, a földgáz (metán, CH4) van égett a levegő oxigénjével felszabadulását nagy mennyiségű hő:
Lásd még az exoterm oldódását fémek savak, semlegesítés, és még sokan mások.
Egy példa egy endoterm reakció kialakulását a szén-monoxid (II) CO és hidrogén H2 szén és a víz, amely csak az, amikor fűtött:
Tehát bármely kémiai reakció kíséri a felszabadulását vagy felszívódását az energia. Leggyakrabban a felszabaduló energia vagy elnyelt hő (legalábbis - formájában világító vagy mechanikus energia). Ez a hő mérhető. A mérési eredmény van kifejezve kilojoule (kJ) 1 mol reaktáns, vagy (kisebb valószínűséggel), hogy 1 mól a reakcióterméket. Ez az érték az úgynevezett a reakcióhőt.
A termikus hatás - a felszabaduló hőmennyiség, illetve szívódik során az áramlás a kémiai rendszer, hogy egy kémiai reakció.
A termikus hatás jelölje Q. A nagysága megfelel a különbség az energiákat a kezdeti és végső állapotok a reakció.
Az exoterm reakciók Q> 0.
A endoterm reakciók, Q <0.
Hívjuk ezt a jelenséget a termikus hatás. bár pontosabb lenne beszélni az energia a reakció hatása.
Egyenletek szemléltető kémiai reakciók egy termikus hatás, az úgynevezett termokémiai. Ezekben az egyenletekben, fontos figyelembe venni a halmazállapotát anyagok a reakcióban résztvevő, és az értéke a termikus hatás kJ.
Rendeltetése fizikai állapota, nagyon fontos. Például, egy hidrogén égési reakció, víz képződik kezdetben a gőz (gáz halmazállapotú), amelynél a kondenzáció állni némi energiát. Következésképpen, a formáció a víz mint folyadék a mért reakcióhő valamivel nagyobb, mint a kialakulását csak gőz, mert a gőz kondenzációs hő kiosztani egy másik része.
Használt, mint egy speciális esete a termikus hatása a reakció - égéshő. A név látható, hogy az égéshő jellemzésére használt anyag üzemanyagként használt. fűtőérték említett 1 mol anyag, amelyben a tüzelőanyag (redukálószer az oxidációs reakció), például:
ahol 1300 kJ - égéshője acetilén.
Ha a reakció reverzibilis, és iránya ellentétes, a hőt a forward és reverz reakciók egyenlő nagyságú és ellentétes előjelű lesz.
energia (E) tárolt molekulák lehet halasztani az energia skála. Ebben az esetben, a reakcióhő (# 916; E) grafikusan megjeleníthető.