szén-oxidok - a feladatok, kontroll


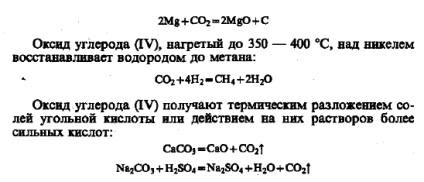
Szén-monoxid (II) (szén-monoxid) - színtelen gáz, szagtalan íze, rosszul oldódik vízben. Olvadáspont - 205 ° C, forráspont hőmérséklet - 191 ° C, és a relatív molekulatömege SB 28, így nem nagyon különbözik a sűrűbb levegő. Szén-monoxid - mérgező anyag. Mérgezés kíséri enyhe szédülés, fejfájás és hányás. Súlyos mérgezés halálhoz vezet. A mérgezési hatás a CO mert alkot erősebb, mint az oxigén, a vegyület a hemoglobinhoz. Ebben az összefüggésben, törött oxigén transzfer a tüdőből a szövetekbe. A formális oxidációs fokú szén-2 nem tükrözi a szerkezet a CO molekula. A CO-molekula, amellett, hogy a kettős kötés által kialakított szocializáció szén elektronok és az oxigén, van egy további, harmadik csatlakozás (nyíl mutatja) kialakított egy donor-akceptor mechanizmus miatt Nepo osztva-pár elektronok oxigén: Ezzel kapcsolatban molekulával CO tartós. Szén-monoxid (II) általános képletű nesoleobrazuyuschim, és nem normális körülmények között vízzel, savak és lúgok. Magas hőmérsékleten, akkor hajlamos a addíciós reakció és az oxidációs - hasznosítás. A levegő, CO égő kék láng: Helyreállítja fémeket ezek oxidjai és sói: besugárzás alatt (közvetlen napfény), vagy katalizátorok jelenlétében CO csatlakozik C12 foszgénné - rendkívül mérgező gáz: Co túlnyomásos sok fémet CO formája illékony karbonilok : kovalens kötés Me -C kialakítva a donor-akdeptornomu karbonil mechanizmus a molekula (lásd § 20.4.). Amikor fűtött fém-karbonil-bomlanak szén- és fém-oxid (II), hogy használják, hogy olyan, magas tisztaságú fémek. A természetben, a szén-monoxid (II) gyakorlatilag nem fordul elő. Meg lehet kialakítva víztelenítéssel hangyasavat (laboratóriumi előállítását): kiindulva az utolsó átalakítás úgy is tekinthető formálisan CO-anhidrid hangyasav. Ezt támasztja alá a következő reakcióban, amely úgy keletkezik halad a CO az alkáli olvadék nagy nyomáson: szén-oxid (IV) (a szén-dioxid, szén-dioxid) - a gáz színtelen és szagtalan, enyhén savanyú ízű, amely nem támogatja a légzés és az égés. Ez nagyon jól oldódik vízben (88 térfogatrész C02 H20 100 térfogat 293 K). Közönséges hőmérsékleten alatt 60 atm szén-dioxid válik folyadék. Való lehűtés után - 76 ° C-on szén-monoxid (IV) alakítjuk szilárd fehér masszává, úgynevezett száraz jég. Szilárd szén-dioxidot átmegy a gázállapotú (szublimál), megkerülve a folyadékot. Relatív molekulatömege szén-dioxid 44, így 1,52-szor nehezebb, mint a levegő. A magas szén-monoxid koncentrációkat (SU) emberekben és állatokban a levegő fojtó. Amikor a tartalom a levegőben 3% emberben ziháló van, 10% - eszméletvesztés és halál, 20% - instant bénulás. Szén-monoxid (IV), mint a savas oxidot reagáltatunk bázikus oxidok és lúgokkal: Amikor vízben oldjuk, a szén-dioxid reakcióba lép vele (kevesebb, mint 1% -a oldott mennyiségét), így rendkívül gyenge és instabil szénsav: On gyengesége az a tény, hogy a a vegyületek van elmozdítva még ecetsav: Szén-dioxid működhet oxidálószer; melegítve szén képezi szén-monoxid: Lit levegő öv fém magnézium folytatódik néhány légköri C02: szén-monoxid (IV), melegítjük 350-400 ° C-on, több mint egy nikkel visszanyeri hidrogén metánná: Szén-monoxid (IV) állítjuk elő hőbontásával sók karbonsavak vagy azok hatása a megoldások az erősebb savak: