Halogének, molekuláris szerkezete - tudja, hogyan
Megvitatása elemek kezdjük a fő alcsoportok a hetedik csoport - halogénatom, amelyek tipikusak a nemfémek
§ 35. Jellemzők halogének atomi és molekuláris struktúra
Halogén-csoport elemei nagyon hasonlóak a tulajdonságaik, Ezért ezeket együtt. Ez kissé eltér a többi fluor. A „halogén” „solerody”. Valóban, az összes a halogénatomok - fluor- F, klór- Cl, bróm- Br vagy jódatom I - közvetlen kölcsönhatás a fémekkel, sók. A halogén és asztácium At, nyitott 1940-ben
Elektronikus konfiguráció halogénatom: F - 1s 2s 2 2 2p 5; Cl - 1s 2s 2 2 2 2p 6 3s 3p 5; Br - 1s 2s 2 2 2 2p 6 3s 3p 6 3d 10 4S 2 4p 5; I - 1s 2 s 2 2 2p 6 3s 3p 6 3d 10 4S 2 4p 4d 6 10 2 5s 5p 5.
Az energia eloszlását a energiaszintek halogén függően magtöltés 11. táblázat
A eloszlása elektron pályák külső elektronikus réteget azonos típusú halogén
A halogének Sok hasonlóság a szerkezet az atomok és molekulák. Ezek befejezett építési p-héj külső réteget, így mindegyikük tartozik a p elem. Külső elektronikus réteg halogénatomok akár teljes hiánya egy elektron, így a elektronegativitási ezen elemek és erősen kifejezett redoxireakcióban viselkednek lényegében oxidáló szerekkel.
A molekulák áll halogénatomok Vuh d (F2, Cl2, Br2, L2), összekötve egy nem-poláros kovalens kötés. Között halogénatomok a molekulák történik egyetlen közös elektronpár. Ez azt jelzi, hogy ezek az elemek egy vegyértékű egyszerű anyagok. A kristályrács a molekuláris halogén típusú.
Halogénatomok különböző rétegek különböznek a számos elektronikus, amellyel kapcsolatban a sugarak különböző halogénatom (táblázat. 11). A növekvő díjat atommagok atomrádiuszok megnő, ami a fokozatos csökkenését a nagysága a elektronegativitási fluort a jód és a csökkenés nemetallichnosti tulajdonságait. A legkifejezettebb körében nemfémes halogénatom fluoratom, kevésbé élénk - jód.
■ 1. Hogyan értéke atomrádiusz függően a növekedés a felelős az atommag?
2. Milyen kémiai kötés molekulák halogének?
3. Milyen típusú kristályrács halogének?
4. Mi a vegyérték a halogén-mentes állapot?
5. Miért kialakulását halogén-molekulákat csak egy elektronpárt atomok közötti fordulnak elő?
6. Hogyan működik az értéke elektronegativitási növekvő atomrádiusz? (Lásd. Response)
§ 36. A fizikai tulajdonságai halogének
Minden a tulajdonságait a halogének, mind fizikai, mind kémiai, függ az atomok az elemek. Ezek a tulajdonságok különböző halogénatommal, nagyon hasonló, de ugyanakkor minden egyes halogén számos funkciók.
Fluor - gáz világos zöld színű, azzal jellemezve rendkívül mérgező tulajdonságai. fluor- forrási hőmérséklete -188 °, dermedési hőmérséklete -218 °. Sűrűség 1,11 g / SM.
Klór - gáz sárga-zöld színű. Azt is mérgező, van egy éles, fojtogató, kellemetlen szag. A klór a levegőnél nehezebb, viszonylag jól oldódik vízben (víz mennyisége per 1 térfogat klórt 2) képező fehérítőt vízzel; Cl2agi meghatározva hőmérsékleten 34 ° folyékonnyá válik és megszilárdul pri- 101 °. Sűrűség 1,568 g / cm3 ..
Bróm -uniqueness folyékony nonmetal. Ez az anyag vöröses-barna, nehéz, ingadozó. A hajó, amely a bróm mindig festette a pár piros-barna színű.
A bróm egy nehéz kellemetlen szaga van ( „bróm”, lefordították orosz nyelven azt jelenti: „büdös”). A vízben rosszul oldódó, alkotó víz brómot Br2aq. Bróm sokkal jobb a szerves oldószerekben oldható - a benzol, toluol, kloroform.
Ha brómos vizet túlfeszültség kis mennyiségű benzol és jól összerázzuk, ez lehet tekinteni, mint színező brómos vizet után eltűnik rétegelválási folyadékok például a benzol ráncolt, felső festett brómot feloldunk egy élénk narancssárga színű. Ez azért van, mert a benzol kivonjuk a víz bróm miatt jobban oldódik benzolban.
Bróm tárolt lombik csiszolt dugóval és kupakkal lezárjuk. Gumidugóval használható brómot, valamint együttműködik a klór, nem vonatkoznak, így azokat gyorsan erodálódott. Bróm sokkal nehezebb, mint a víz (sűrűség 3,12 g / cm 3). brómatom Forráspont 63 °, a megszilárdulási hőmérséklete -7,3 °.
Jód - kristályos anyag, sötét szürke színű, párban - lila. jódot Sűrűség 4,93 g / cm3, olvadáspontja 113 °, a forráspontja 184 °. Hozd az olvadási jód, és különösen a forrásba nem lehet, normál körülmények között, mivel még enyhe hő a szilárd állapotú, azonnal kiderül gőzzé -vozgonyaetsya. Az átmenet a szilárd gáz halmazállapotú, anélkül, hogy a folyadék és vissza hívják szublimáció. Ez a tulajdonság jellemző nem csak a jód, hanem néhány más anyagok. Ez hasznos tisztítására anyagok szennyeződéseket.
Jód rosszul oldódik vízben. Színező jódos vízzel I2aq mindig világos sárga. De ez tökéletesen oldódik. Ezt használják előállítására 5-10% jód oldat alkoholban, úgynevezett jód tinktúra. Jód is oldódik benzolban, toluolban, éterben, szén-diszulfid és más szerves oldószerek. Érdekes, jód igen jól oldódik az oldat saját sók, mint például a kálium-jodid. Ez a megoldás, az úgynevezett Lugol-oldat, széles körben használják a klinikai laboratóriumokban.
Ha a jódos vízzel I2aq adjunk hozzá egy kevés benzint, majd a rázást is képződik a felületen színes benzolgyűrű, de csak magenta színű.
■ 7. Hogyan működik a szín intenzitása halogén növekvő nukleáris díjakat?
8. Mi a neve klór- megoldások, bróm és jód a vízben?
9. Hogyan működik a sűrűsége halogén növekvő nukleáris díjakat? (Lásd. Response)
10. Készít, és töltse ki a táblázat „fizikai tulajdonságai halogének” szerint a következő minta:
11. Amint azt szempontjából a kristályrács szerkezetének kis olvadáspontú és forrásban lévő halogének?
12. Mi jelentése a relatív sűrűség a fluor és klór a levegőben és a hidrogén? Ha nem tudja, mi a relatív sűrűségű gáz a meghatározása, és hogyan kell használni a számítások során, lásd: Függelék II o. 387. Ezután válaszolni a kérdésre.
13. Mennyibe kerül 20 kg klórt normál körülmények között? Ha elfelejtette, hogyan kell kiszámítani a gáz mennyisége normális körülmények között, lásd a függelékben. (Lásd. Response)
§ 37. Fiziológiai halogén
Minden halogének mérgezőek ezek fiziológiai akció. Különösen fluor-toxikus: inhalációs kis mennyiségben okoz tüdőödéma, nagy - a tüdőszövet és a halált.
Klór - is nagyon mérgező anyag, bár kisebb mértékben. Az első világháború is használták, mint egy vegyi fegyver, mert a levegőnél nehezebb és tartják is a föld felett, különösen szélcsendes időben. Legnagyobb megengedett szabad klór koncentrációja a levegőben 0,001 mg / l.
Krónikus mérgezés klórral változást okoz a bőrszín, a tüdő- és légúti betegségben. Amikor mérgezés klóratommal antidotumként kell alkalmazni egy éter-alkohol gőz és vízgőz elegyített ammónia, amely szükséges, hogy előre vigye friss levegőre.
Ugyanez kis mennyiségű klórt is gyógyítani a felső légutakban, mint káros hatása baktériumokon. Mivel a fellépés a klór fertőtlenítő fertőtlenítésére használt csapvíz.
brómatom pár fulladást okozhat. Mérgező és folyékony brómot okozó Bőrrel súlyos égési sérülést. Dekantáljuk brómot egyik edényből a másikba ajánlott gumikesztyű és alatt a tapadást.
Érintkezés bróm mosás egy szerves oldószerrel - benzolban vagy szén-tetraklorid, dörzsöli az érintett területet vattával átitatott ezeket az oldószereket. Amikor öblítése brómos vizet gyakran nem lehetséges, hogy elkerülje az égési sérüléseket.
Jód a legkevésbé toxikus minden halogének. Belégzése jódgőzt hevítve, mérgezést okozhat, de működő jódgőzzel esik ritkán, például a tisztítására a szublimáció. Kristályos jód kezet nem kell figyelembe venni, mint a bőrre ez okozza a jellegzetes sárga foltok. Minden munkát el kell végezni halogének elszívófülkében.
Azonban halogének fontos eleme. Klór formájában konyhasó folyamatosan használt élelmiszer, valamint része a zöld növényi anyag - a klorofill. Hiánya a fluor ivóvíz okozza a fogszuvasodást. A jód nélkülözhetetlen minden élő szervezet, mind a növényi és állati. Részt vesz az anyagcsere szabályozásában. Emberekben, a jód koncentrálódik főként a pajzsmirigy, és részt vesz a kialakulását a hormon. A jódhiány elváltozásokat okoznak a pajzsmirigy. Ahhoz, hogy a betegségek megelőzése az élelmiszer igen kis mennyiségben adunk hozzá jódot, elterjedésének néhány csepp jód tinktúra egy pohár vízben, de gyakran formájában nátrium-jodid és kálium-jodid.
• Felvétel egy notebook biztonsági óvintézkedéseket foglalkozó halogének és elsősegély mérgezés esetén.
§ 38. Kémiai tulajdonságok halogének
A természet a kémiai tulajdonságok, mint fentebb megjegyeztük, az összes halogén tipikus nemfémek, amelynek nagy elektronegativitása. A leginkább elektronegatív elemnek a legnagyobb nemfémes aktivitás fluor-, a jód a legkevésbé aktív.
Kölcsönhatás halogén egyszerű anyagokkal. Pálya reaktivitáscsökkentő fluor-, hogy klórt a példákban lehetnek különböző reakciókat. Különösen érdekes interakció különböző halogének hidrogénnel. A reakciókörülményeket egyidejűleg különböző.
Így, fluor reakcióba lép a hidrogénnel ryvom hozott még sötétben is. Ez képezi a hidrogén-fluorid az alábbi egyenletnek megfelelően.
H2 + F2 = 2HF
Hidrogén-fluorid a legerősebb között hidrogén-halogenidet.
A reakciót a klór hidrogénnel történik robbanásszerűen csak fény:
H2 + Cl2 = 2HCI
Ha gyullad áramban hidrogén-klorid a légkörben, akkor könnyű lesz színtelen láng éget (ábra. 21).
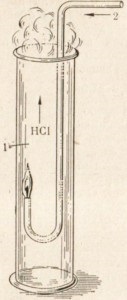
Ábra. 21. égetése hidrogén klórt.
1- klór
hidrogén-2-
Hidrogén-bromiddal, hidrogén-brómot formák.
Br2 + H2 = 2NVg
A folyamat alatt enyhe melegítés.
Jód reagál a hidrogén csak akkor, ha melegítjük, hogy a hidrogén-jodid:
H2 + I2 = 2Ni
Azonban, ez a vegyület nagyon instabil és könnyen szétesik hidrogén és jód. Minden ilyen esetben halogénnel úgy viselkednek, mint oxidáló szerek. Halo-hidrogének, amikor vízben oldjuk savakat képezni.
Oxidáló halogének mutatnak tulajdonságok, és a kölcsönhatás a fémek, amelyek során általában nagyon aktívan.
Fluorid reagál gyakorlatilag majdnem minden fém. Ez könnyű nyomon követni a kommunikációt x h r fém. Sok fémet a klór égési, például antimon autoignites (ábra. 22). Más fémek reagálnak klórral vagy melegítés közben, például a nátrium-(ábra. 23).
2Na + Cl2 = 2NaCl
Ha fémek különböző mértékű oxidáció, ezek tipikusan a legmagasabb a reakció során a klórt. Például.
2Fe + 3Sl2 = 2FeCl3
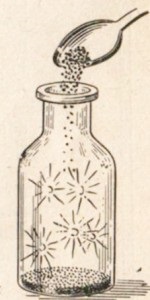
Ábra. 22. Öngyulladási antimon klórral
Itt, a vas a reakcióban klórral van egy oxidációs állapotú +3 - Fe +3. réz és egyenlő + 2- Cu +2. Mindezekben az esetekben klór viselkedik, mint egy oxidálószer.
Hevesen reagál fémekkel és bróm. Ha egy öntsük csövet folyékony brómot bites alumínium chipek, azok égett brómot képződése az alumínium-bromid, amely kíséri megjelenése barna brómgőz és szikra. A reakció a következő egyenlet szerint:
= 2AL + ZVr2 2AlVr3
Tapasztalat termelődik a készülék ábrán látható. 24. A a cső hossza 1 viselkedik, mint egy léghűtő. Burn a bróm és ón. antimon. és a kálium-brómmal kezelve egy hangos robbanás.
Jód is reagál fém, alkotó jodid sót. Különösen érdekes történik alumínium vegyületet jóddal. Erre a célra, a jód kristályokat eldörzsöljük mozsárban, egy finom port, majd elkeverjük jód asbestirovannoy rács alumínium port. A keveréket, edények és anyagok tökéletesen száraznak kell lenniük. Ha ezután hozzáadjuk a vízcsepp, amely katalizátor ebben a folyamatban, a keverék begyullad és az égési sérülések, elosztásának klub lila jódgőzzel
2AL + 3I2 = 2AlI3
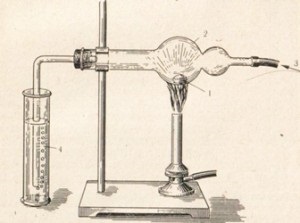
Ábra. 23. Az égés nátrium-tartalmát a klór.
1- fémnátrium
2- hlorkaltsivaya csövet
3- klór
4- kálium-hidroxid
Meg kell jegyezni, hogy a jód reakcióba lép a fémekkel keményebb, mint a klór- és bróm-atom.
Ellentétben a legtöbb más egyszerű anyag halogének közvetlen interakció oxigénnel nem lép be, mint a halogének és oxigén hasonló elektronegativitási értékeket. Azonban, halogén-oxigén-vegyületek kapott közvetve van.
■ 14. Igazoljuk elkészítésével elektronikus mérleg, amely a reakciók hidrogén- és halogénatomok fémek viselkednek, mint oxidálószerek. Indokoljuk szerkezet ilyen viselkedést halogénatom.
15. Mi az a mennyiségű hidrogén-kloridot úgy állíthatjuk elő reakcióelegyet hidrogén-kloriddal 20 l? (Ezt a problémát meg lehet oldani teljesen kötetek).
16. A kapott hidrogén-klorid nem volt szennyezett klór, klórral és hidrogén reakciójával az utóbbi vegye fel 5% -a a kívánt mennyiséget. Számítsuk ki, hogy mennyi hidrogénatom kell venni, hogy így 50 liter hidrogén-klorid. (Lásd. Response)