A fajhő, a Poisson-arány
3. Az izoterm folyamat.
Izotermikus eljárás egy olyan eljárás eljárásban állandó hőmérsékleten. Ebben az esetben. azaz a belső energia a gáz állandó marad, és az összes bevitt hő költenek a munkát.
4. Az adiabatikus folyamat.
Process előforduló nélkül hőcsere a környezettel, az úgynevezett adiabatikus. Ebben az esetben. A termodinamika első főtétele az ilyen eljárás a következő lenne:
azaz során adiabatikus vagy kompressziós folyamat munkát csak gázt változások miatt a belső energia tartalékokat.
Levezetjük az egyenlet a adiabatikus folyamat. Egy adiabatikus munkát rovására veszteség a belső energia. Mivel mind. az
Osztódó (6) egyenlet és az utolsó megadott (8) egyenlet, megkapjuk
ahol - az arány specifikus melegíti.
Integrációja és potencirozására utolsó egyenletet, megkapjuk Poisson-egyenlet
Szerint a gázok kinetikus elméletét (4) és (7), megkapjuk
Ez a képlet érvényes mind moláris és fajlagos hőkapacitása gázok.
A módszer leírása és elmélet
A javasolt módszer a meghatározására adiabatikus index használatán alapul adiabatikus és izochor folyamatok.
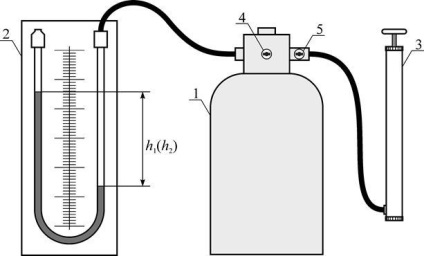
Ábra. 17. Kísérleti beállítás
A létesítmény áll egy 1 henger csatlakozik nyomásmérővel 3, és a 2 szivattyú (lásd ábra. 17). Azáltal, daru segítségével a 4 henger lehet csatlakoztatni a légkörbe, és ennek megfelelően, a kezdeti nyomás abban megegyezik a légköri nyomás. Crane 5 szolgál, hogy lezárja a levegő a pumpa. Amikor egy szivattyú használatával gyorsan növeli egy léggömb kis levegőt és zárja a szelepet, a henger nyomás növekedni fog, de ha ez a növekedés történt elég gyorsan, a manometrikus oszlop nem azonnal veszi a végső helyzetét, mivel a levegő kompressziós lenne adiabatikus és következésképpen annak hőmérséklet-emelkedés. Végső szintkülönbség a manométer jön létre csak akkor, ha a hőmérséklet a tartály belsejében egyenlő miatt a hővezető a falak, a környezeti hőmérséklet.
Jelöljük termodinamikai környezeti hőmérséklet és ezen keresztül - a gáz edény belsejében a nyomás, a megfelelő jelzés manométer. Nyilvánvaló, hogy a nyomás, állítsa az edényben, egyenlő lesz
ahol - a nyomás növekmény, valóban megtörtént növelésével lévő levegő tömege a hajó, mint egy olyan levegő tömege a kiindulási állapotban.
Ez a két paraméter jellemzi az állam a gáz, amit úgy hívunk az első állam a gáz.
Során gyors megkezdéséhez a konténerdaru levegő áramlik ki a légkörbe, azaz bővíteni, amíg az edény nyomás megegyezik a légköri nyomás. Ez a növekedés elég gyors, és a rendszer nem hőcsere a környezettel. Következésképpen, a levegő adiabatikusan expandál, ami annak hőmérséklet csökken, hogy egy bizonyos értéket. Maradék az edényben a légtömeg állapotában van jellemezhető nyomást. hőmérséklete és térfogata. az úgynevezett második állapotot.
Ha ezt követően ismét közel szelepet, majd a nyomás és a hőmérséklet a csapdába ejtett levegő tömege indul izochor edényben történő hőcserével melegítjük a környezettel, amíg a külső és belső hőmérséklet a hajó nem lesz ugyanaz. A nyomás az említett légtömeg növeli egy bizonyos összeget, és egyenlővé válik
Ennek eredményeként már egy harmadik állam, a levegő a paramétereket. . és.
Air adiabatikus átmenet az első állapotból a második által leírt Poisson törvény (9), amely segítségével az állam (2) egyenlettel írható fel
7.5. tesztkérdések
1. Mi az úgynevezett specifikus (mol) hőkapacitása az anyagot?
2. Szerezd meg a kapcsolat a konkrét felmelegíti és moláris ideális gáz, hogy az első főtétele.
3. Az úgynevezett több szabadsági fokkal egy molekula? Mi több szabadsági fokkal egy egyatomos, kétatomos, háromatomos gáz?
5. Mi a Poisson-tényező? Hogyan magyarázza, hogy az ár-érték bármilyen gáz nagyobb, mint egy? Mi a Poisson a levegő?
6. Milyen folyamatok zajlanak a levegő ebben a munkában? Milyen törvények engednek?
7. Mi a nevezett folyamat adiabatikus? Kap ez a folyamat egyenlet az ideális gáz, hogy az első főtétele és állapotegyenlet.
8. Draw koordinátákon adiabatikus és izotermikus folyamatok.
9. jóváhagyja a törvény ekvipartició energia felett szabadsági fokú molekulák? Mennyi való alkalmazhatóságának?