2 nemfémes nemfémes bináris vegyületet
2. Nem-fémek + nemfémes = bináris vegyületet.
A legtöbb nem-fémek reagálnak más nemfém hevítve, alkotó bináris vegyületek (non-fém egy kisebb elektronegativitási működik, mint egy redukálószer, a nagyobb -, mint oxidálószer). Kivételt képez ez alól a reakció között halogénatom (kivéve F2) és az oxigén, halogén-oxidok így kapott közvetett módszerekkel. F2. mint a legtöbb aktív nem-fém, ez reagál az összes nem-fémek (robbanásszerűen H2), szokásos körülmények között.
3. Fém (a sorban feszültségek Al) + H2O =-hidroxid + H2.
Fém (az elektrokémiai sorban a mangán és a H2) + H2Ooksid + H2.
Fém (az elektrokémiai sorban után H2) + H2O (nincs reakció).
Fémek állva az elektrokémiai sorban Al, befogadó, a vízzel reagál normál körülmények között, amely egy fém-hidroxid és hidrogén (Mg reagál hevítve, Al -. Amikor eltávolítja a sűrű Al2 O3 Be oxidfilm nem reagál a vízzel). Például:
2K + 2H2 O = 2KOH + H2.
Metals állt az elektrokémiai sorban Al H2. reagáltatunk túlhevített gőzzel, hogy a hidrogén és fém-oxid:
3fe + 4H2O = Fe3 O4 + 4H2, 2CR + 3H2 O = Cr2 O3 + 3H2.
Metals állt az elektrokémiai sorozat után H2. nem lépnek kölcsönhatásba a víz:
Cu + H2 O (nincs reakció).
4. nemfémes + víz.
Normális körülmények között a víz kölcsönhatásba lép csak F2. Ez képezi bonyolult összetételű anyagok fogása atomos oxigén magas kémiai aktivitása:
Részben a víz kölcsönhatásba Cl2 és Br2. de a mérleg ezen reakciók erősen eltolódott balra:
Cl2 + H2 O HCI + HSlO, Br2 + H2 O HBr + HBrO.
Néha ezek a reakciók elhanyagolt, tekintve, hogy ők foglalkoznak Cl2 és Br2 vizes oldat - a klór és bróm vizet.
Magas hőmérsékleten, néhány nem-fémek reagálnak vízgőzzel:
C + H2 O = CO + H2, Si + 2H2 O = SiO 2 + 2H2.
Kölcsönhatásai fémek és nemfémek más vegyületekkel tanulmányozni fogják később.
P r o e e r e a b i
1. gyakorlat nyilak jelölje meg a kölcsönhatás a víz a fémek.
2. gyakorlat befejezni a következő egyenletet:
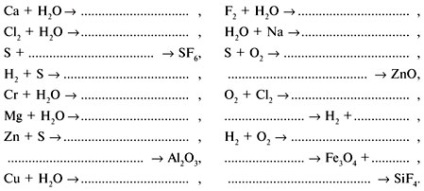
3. gyakorlat: Határozza meg, mely elemei a kérdést:
a) A elem - on folyékony STP fém. ;
b) a nem-fém B reakciójával vízgőzzel formák homok. ;
c) Az elem képez két gázállapotú egyszerű anyagnak. ;
g) egy elem F képezi a legegyszerűbb gázhalmazállapotúak n. y. egyszerű anyag. ;
e) az oxid-M - a legelterjedtebb a világon.
4. gyakorlása szerinti reakciók egyenlete rendszerek (külön notebook):
a) C H2NaH H2H2 O KOH;
b) Cl2HCl H2H2 O HCl;
a) N2Ca3 N2NH3.
5. gyakorlatban reakcióvázlatok meghatározó anyagok A, B és C (A és B - egyszerű, azaz álló atomok egyik eleme):
A + B H2 O, B + Cl2C.
7.1. Klassifikatsiya oxidok
Oxidok - vegyületek atomjai két elem, amelyek közül az egyik jelentése oxigénatom, az oxidációs állapotban -2.
Az oxidok oxigénatomok kapcsolódnak csak atomok másik elem, és nem kapcsolódik egymással. Tartalmazó vegyületek a struktúrájában közvetlen kapcsolatban egymással oxigénatom (-O-O-) hivatkozunk peroxidok.
Nem képezik oxidok Nem csak, Ne, Ar és F. Vannak magasabb oxidokat. amelyben az atom az elem mutat nagyfokú oxidációs (jellemzően egyenlő a csoport a számát, amelyben az elem), és az alsó oxidok - azok, amelyekben az elem atom mutat alacsonyabb oxidációs állapotú. Oxidok egy elemét tartalmazó atomok különböző oxidációs állapotban van úgynevezett kettős, például:
Fe3 O4FeO • Fe2 O3. Mn3 O4MnO • Mn2 O3. Pb2 O3PbO • PbO2.
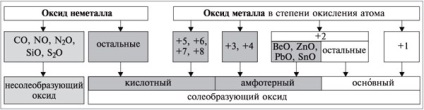
A kémiai tulajdonságok oxidok vannak osztva sóképző (sókat képeznek savval reagáltatva és / vagy bázisokkal) és nesoleobrazuyuschie (nem képeznek sókat, közömbösek savak és bázisok, és tartalmazzák a CO, NO, N2 O, SiO, S2 O).
Sok sóképző oxidok csatlakoztatott víz. Ezt a folyamatot nevezik hidratációs és a termékek - hidrátjai, oxidok vagy hidroxidok (tartalmazhat egy vagy több hidroxilcsoportot -OH).
Egyes oxidok nem reagálnak a vízzel, a hidroxidok nyerhető közvetve.
Oxid és -hidroxid megfelelnek egymásnak, ha azok tartalmazzák az azonos elem azonos mértékű az oxidációs.
Sóképző oxidok szétválasztjuk nyílt Ba, sav és amfoter típusától függően a megfelelő hidroxidot. Kislotno-Ba manifeszt tulajdonságokkal kapcsolatos hidroxidok és -oxidok (Na2 O és NaOH, SO3 és H2 SO4) covpadayut.
Az alapvető hívás oxidok, hidroxidok, amelyek megfelelnek - bázis.
Kislotnymi nevezett oxidok, hidroxidok, amelyek megfelelnek - sav.
Úgynevezett amfoter oxidok, amelyek megfelelnek amfoter hidroxidok.
Nem-fémek csak képez savat és nesoleobrazuyuschie oxidok; fémek alkotnak minden nyílt Ba, minden amfoter és néhány savas oxidok. Sok fémek másodlagos alcsoportok, a vegyületek, amelyek változó sd képezhet több-oxidok és -hidroxidok, amelynek természete függ sd atomi elem. A növekvő oxidációs foka atomi elem növeli elektronegativitási. Ennek megfelelően, megnöveli a nem-fémes tulajdonságokat egy elem, valamint a sav tulajdonságainak egy oxid és hidroxid.
fém-oxidok sd atomok +1 (Na2 O, K2 O et al.), és a legtöbb fém-oxidok sd atomok +2 (FeO, MgO, stb) látszólagos Ba. Kivételek: BeO, ZnO, PbO, SnO - amfoter. A legtöbb fém-oxidok sd atomok 3 és 4 - amfoter (Al2 O3 Cr2 O3 Fe2 O3 SnO2 PbO2, stb .....). fém-oxidok sd atomok +5, +6, +7, +8 - sav (Mn2 O7 CrO3 Sb2 O5, stb ....) (1. reakcióvázlat).
P r o e e r e a b i
1. Gyakorlat válassza ki a általános képletű oxidok, nevét és ezek összetétele a grafikus képletek (oxidok a kapcsolatok száma egyenlő a E-O tagja sd atomot, O-O kötéseket nincsenek jelen):
Feladat 2. Készítsen grafikus képletek anyagok:
szén-dioxid, szén-monoxid, nitrogén-oxid, égetett mész, alumínium-oxid, magnézium-oxid, szilícium-dioxid, kén-dioxid.
3. gyakorlat Anélkül, hogy a periódusos rendszer (SS), hogy meghatározza, mely csoport a kémiai elemeket képező magasabb oxidok:
Exercise Formula 4. Készítsen magasabb oxidok elemeinek atomszáma 14, 34, 41, 75, 33, 50, 40, hívja őket, és azonosítani jellegük (bázikus, savas, amfoter, nesoleobrazuyuschy).
5. Gyakorlat grafikusan képletek és a természet előretöltött oxidok:
a) nitrogénatom oxidációs állapotai +1, +2, +3, +5;
b) klóratom és oxidációs állapotok a +1, +3, +5, +7;
c) oxidációs mangán atommal fok +2, +3, +4, +7.
Exercise 6. írása képletű előretöltött természetét és magasabb oxidok elemek: a) PS Csoport VIa; b) A harmadik időszak az SS. Kakaya mintázat létezik változó a tulajdonságok a magasabb oxidok elemeinek időszak?
Feladat 7. Határozza meg a következő adatokat tartalmazza:
a) egy eleme a 3. harmadban, magasabb oxid - A2 G5. ......................... ;
b) egy eleme a 2. időszak, nagyobb-oxid - EO2. ......................... ;
c) A PS Csoport V elem, képez magasabb oxidok, ahol az összes a protonok száma a molekulában kevesebb, mint 80, és a teljes elektronok száma nagyobb, mint 55, ...................... ;
g) az elem X képez két bináris vegyületek oxigénnel, amelyek közül egyik sem oxid nem ...................... ;
d) Y elem alkotja két gázformájú oxid (sd egyenlő 2 és 4), egyikük - nesoleobrazuyuschy ......................... ;
e) Z elem formájában egyszerű anyag tartalmazza az összetétel a légkör, alkot két nesoleobrazuyuschih-oxid és számos sóképző ...............................
Feladat 8. szakirodalmi forrásokra, meghatározzák fizikai állapot, szín és a volatilitás a következő oxidok:
7.2. Az oxidok és a megfelelő hidroxidok
Activity Program 4. számú
„Általános képletű vegyület előállítása-oxid a hidroxid”
Példák problémák megoldásához általános kémia. Neorganicheskoyhimii. Szerves kémia. Általában ez tartalmazza az összes téma. (Szerkezeti képlet vegyi stepenokisleniya szervetlen anyag osztályok, rajz kémiai képletek. Oxidjai.
Munka tananyag
képletek stepenokisleniya tesztek a kémiában Surovceva RP Guzey LE. Popova OA Test munka neorganicheskoyhimii NP Gavruseyko.
eiektronegativitás vegyérték stepenokisleniya; -Főbb kémia elmélet. szerkezetét szerves vegyületek. Nem-fémek. Szervetlen és szerves savak. szervetlen és szerves bázisok. Amfoter szervetlen és szerves.
Munka tananyag