Intermolekuláris vonzás - Referencia vegyész 21
Kémia és Vegyészmérnöki
Olvadáspont akkor történik, amikor a hatékony keresztmetszet. per egyik lánc válik -Mi által megengedett intermolekuláris vonzóerők. kristály kötés. [C.230]
Amikor szétválasztása molekulák egy nagy tartalék energia a felület a teljes energia hagyva az elpárolgó folyadékot újra elosztják a környező gáztérbe gyors molekula. leküzdése intermolekuláris vonzóerő. fogyasztanak része az energia elvégzésére szétválasztási művelet, ahol is az energia maradt molekulák a folyékony második folyadék fokozatosan csökken lehűtjük. A bepárlási folyamat történt T = 1
Do arány intermolekuláris vonzóerő más folyadék tulajdonságai, mint a viszkozitás vagy dermedési Look könyvtárak és keresse pentán, oktán, dekán szerint növekvő sorrendben viszkozitását. A tanár ellenőrzi az adatokat. [C.184]
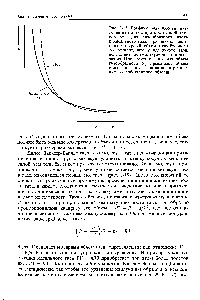
Ábra. 3-18. menshenie igazi gáznyomás következtében intermolekuláris vonzás. [C.154]
Valódi gázok tulajdonságait. nem sokban különbözik az ideális, mert a molekulák valójában nem pont tömegeket. megfosztva kötet, és mivel ezek a molekulák vonzzák egymást. Intermolekuláris vonzás nem elhanyagolható az adott körülmények között, ahol a molekulák lassabban mozognak, mint ez történik alacsonyabb hőmérsékleten jelenlétében saját térfogatának molekulák kezd kialakulni egy erős tömörítés a gáz. Mindebből következően a gázok megközelítik az ideális jobb magas hőmérséklet és az alacsony nyomás. [C.157]
A hőmérséklet-emelkedés megakadályozza, hogy a atomok közötti erőkkel (intermolekuláris) vonzás hozzájáruló rendelési rendszer. és felerősíti a kaotikus mozgás. t. e. a felbontási a részecskék. Ezért, nagyon alacsony hőmérsékleten, túlsúlyban első tendencia, nagy - a második. Valóban, ha a folyamatok szintézisének molekuláris társulás és anyagok annak végrehajtására, általában kívánatos az alacsony-hőmérsékleti viszonyok, a bomlási reakciók tipikusan magasabb hőmérsékleteken. [C.48]
A termelés csak a belső viszkozitás a polimerek, amelyek lineáris makromolekulákból flexibilis vagy enyhén elágazó formákat alkalmazhatunk nagy molekulatömegű kohéziós biztosítása erős tapadást makromolekulák az intézkedés alapján az intermolekuláris vonzóerők. molekulatömeg tartományban 10-10 -10 és kellően szűk molekulatömeg-eloszlású. [C.410]
Attól függően, hogy az értékek az intermolekuláris attrakciója nemideális rendszerek aktivitása nagy élő együtthatók lehetnek kisebb egységét. A számértéke aktivitási együttható függvénye az összes többi komponens az oldatban és koncentrációik. Például, az A komponens a biner elegy Va = b, ha X =. mint a tiszta folyadékok minősülnek ideális megoldást. Ahogyan a szint csökken, veri növekszik és eléri a maximális x = 0 Hasonló függést figyeltünk meg a többi komponenssel. [C19]
A lineáris polimerek inkább jellemző ábrán látható. 214 szakítószilárdság függés a polimerizációs fok R. A kis R szilárdság alacsony, de növekedésével gyorsan emelkedik polimerizációs foka 100-300, és mivel a P egyenlő 400, közel állandó marad. Ez annak köszönhető, hogy az a tény, hogy amikor a kis mennyiségű polimer molekulák törni kell leküzdeni csak a viszonylag gyenge intermolekuláris vonzó- (molekulák siklanak egymással, és amikor a fájdalom nyak lánc hosszát. Következménye a fenti jellemzők [c.588]
Intermolekuláris erők a vonzás az abszolút értékek nagyon jelentős, és eléri a maximuma közötti távolságot a részecskék mensche képest jelentősen méretük. Szemcseméret növekedésével a saját távolságok intermolekuláris vonzóerőkkel valamelyest csökken. [C.40]
Ezen kívül vannak más okok miatt. ad okot, hogy kohéziós erők a részecskék között, és meghatározzuk az értéke a további kifejezés, hogy hosszirányú kihajlás alatt állandó réteg (1,3). Ez például a páratartalom, létrehoz hidak hajszálérrétegeket körülvevő kapcsolati részecskéket. Ezután a statikus elektromosságot. Majd a keletkezett súrlódási részecskék. A nagyon kis részecskék, amelyek átmérője 40-60 mm kezdenek jelentős szerepet játszik a van der Waals erők intermolekuláris vonzás a felületi rétegek a szemcsék. [C.26]
A leírt szerkezet a polimer úgy viselkedik, mint egy koagulációs szerkezetet. A hasonlóság a viselkedése e struktúrák az, hogy jellemzi a kémiai kötések a részecskék és a nagyságrenddel kisebb részecskék közötti kölcsönhatásokat. A növekvő polaritás a makromolekulák csökken a rugalmasság, valamint a molekuláris kölcsönhatások jellemzőek mind a három fajta van der Waals-erők. A jelenléte ezen funkciós csoportok. Mindkét 0H, -COOH, -YNg, okot ad egy erősebb hidrogénkötések. A növekvő intermolekuláris vonzás a polimer merevebbé válik, kevésbé rugalmas vagy akár rideg anyag. vesztes egyenletes eloszlása és az oldhatóság. Polimerek amelyben a kémiai kötéseket makromolekulák közötti (térbeli) oldhatatlanok, és infúzióval beadható melegítés hatására. Szerint a tulajdonságok felelnek meg kondenzációs struktúrák. [C.391]
Más szóval, az izotróp hőre lágyuló rideg anyaggyengítés csak egy kis részét (kevesebb mint 1% az összes fő kapcsolat) van egy teljesen feszített állapotban. Ilyen körülmények között, az instabil repedésterjedési Kezdetben által meghatározott intermolekuláris vonzás. Visszatérve az adatok a Vincent, el kell mondani, hogy ez nem a számos alapvető csatlakozások egységnyi területen és a bennük rejlő erejét és értékét az intermolekuláris erők határozza meg a makroszkopikus erejét. A magas értékek ereje miatt sűrű. [C.83]
Ha két atom különböznek a belső tulajdonságaik, hogy vonzzák a elektronokat. t. e. a eiektronegativitás a elektronpár. által, amely létrehoz egy kémiai kötés közöttük. eltolódik az atom a nagyobb elektronegativitási és rajta van egy negatív töltés. és a többi, az atom pozitív töltés. Az ilyen kapcsolatok és a molekulák, amelyek arra hivatottak poláris. Poláris molekulák nem csak vonzza lrug más, de azt is vonzza a pozitív vagy negatív ionok magukat. Forráspont hőmérsékletű és olvadáspontú anyagok poláris molekulái magasabb, mint várható lenne. ítélve csak a nagysága a van der Waals erők a vonzás, mivel a polaritás a molekulák okozza a megjelenése további erők az intermolekuláris vonzás. [C.52]
A párolgási hőt. hogy pontos legyek - a teljes párolgási hő folyadék. áll a két komponens 1) a fordított energia, hogy legyőzzük az erőket az intermolekuláris vonzás a folyadék (beleértve az Association), az úgynevezett belső hő MSPA-rénium, és 2) a fordított energia leküzdeni a külső nyomást elosztása során gőz. úgynevezett külső hő (tűz művelet) elpárologtatjuk és egyenlő PAV. Külső hő- mindig sokkal kisebb, mint a belső. A jövőben csak azokat a teljes párolgási hőt, elnevezése a rövidség kedvéért, a párolgási hője. [C.173]