A szerkezete és működése komplex fehérjék
Topic: „A szerkezet és a funkció komplex proteineket. Szerkezete és működése, mioglobin és hemoglobin "
1. meghatározása és osztályozása az alapelvek komplex fehérjéket. Példák.
2. glikoproteinek: szerkezeti jellemzői, példák, funkciók. Immunglobulinok: szerkezeti jellemzők, immunglobulin osztályokat, ezek szerepe a szervezetben.
3. foszfoprotein: képviselői kötelező protézis csoport apoproteinje, szerepe a szervezetben.
4. metalloproteinek: képviselői a természet a prosztetikus csoport és annak kötődését a apoprotein, a szerepe a metalloprotein a szervezetben.
5. Szerkezet és funkció chromoproteins (például mioglobin és hemoglobin). Alloszterikus tulajdonságait hemoglobin. Kooperatív hatást. A szerepe a CO 2 hidrogén ionok, és a 2,3-difoszfoglicerát szabályozásában a hemoglobin affinitását oxigént.
6. Az hemoglobin (deoxihemoglobin, oxihemoglobin, karbgemoglobin, karboxihemoglobin, methemoglobin cyanmethemoglobin), azok jellemzőit. Okai és következményei a felhalmozási methemoglobin a vérben.
7. molekuláris formáját a hemoglobin. Magzati hemoglobint, szerkezeti jellemzők, tulajdonságok, és a biológiai szerepe. A sarlósejtes hemoglobin (HBS), szerkezeti jellemzők, tulajdonságok, megnyilvánulásai hemoglobinopathies S.
A koncepció egyszerű és összetett fehérjék. Osztályozása összetett fehérjék.
3.2.1.Lipoproteiny - komplex tartalmazó fehérjék, mint a prosztetikus csoport a lipidek, és ezek származékai. Képviselői a kilomikronok és egyéb lipoproteinek frakciók. Lipoproteinek a közlekedési forma lipidek a vérben. További részletek az ebbe a csoportba tartozó komplex fehérjék látott „lipid Exchange” részben.
3.2.2.Nukleoproteiny - fehérje komplex, amely tartalmazza például a nukleinsav prosztetikus csoport. Nukleoprotein közé tartoznak a vírusok, a riboszómák, kromatin a sejtmagba. Kétféle a nukleoprotein 1) ribonukleoproteinkomplexek. amelyek magukban ribonukleinsav (RNS); 2) dezoksiribonukleoproteiny. amelyek magukban dezoxiribonukleinsav (DNS). Szerkezete és tulajdonságai nukleinsavak kell tekinteni később.
A különlegessége a fehérje a nukleoprotein, hogy áll számos pozitív töltésű aminosav. Tehát a dezoksiribonukleoproteinov közé hisztonfehérjéknek gazdag lizin és az arginin. ionos kötések alakulnak között a fehérje és a nem fehérje komponensek nukleoprotein (mivel nukleinsavakat negatív töltésű).
3.2.3. Foszfoproteinek tartalmazhat a készítmény, foszforsav-maradékokkal, kapcsolódik a maradék hidroxi aminosavak (szerin, treonin) útján észterkötések. Ahhoz, hogy ez a csoport a komplex fehérjék közé kazeinogen tej, tojás fehérjék ovalbumin és Witelo. Sok intracelluláris fehérjék foszforilált. Joining foszfátcsoport egy protein gyakran okoz változást annak funkcióit.
A foszforilezést fordított folyamat - defoszforilációja - közös mechanizmusát szabályozása fehérjék biológiai aktivitását. Például, foszforilációját hisztonok csökkenti a képességüket, hogy kötődnek a DNS-t, és hogy részt vegyenek a szabályozásában mátrix szintézisét DNS.
3.2.4. Metalloproteinjeinek. Ha a fehérje tartalmaz egy vagy több, ionok, fémek, mint fehérjék nevezzük metalloprotein. A fémionok vannak csatlakoztatva koordinációs kötések a funkciós csoportokat a fehérje és részt vesznek fenntartásában annak térszerkezetét. Metalloproteinjeinek gyakran enzimekkel.
Transzferrin - oldható zhelezoprotein szereplő vérszérumban részeként β-globulin. A transzferrin-molekula tartalmaz 2 ion Fe 3+; Ez a fehérje hordozójaként szolgál a vas a szervezetben.
A ferritin - intracelluláris globuláris protein, található elsősorban a lépben, máj, csontvelő, szerepét betöltő vasraktárak a szervezetben. Due citoszol ferritin vasraktárakat tartjuk fenn oldható és nem-toxikus formában.
Hemosziderin. Ellentétben a ferritin és a transzferrin, egy vízben oldhatatlan vas-tartalmú protein komplexet. Megállapítást nyer, főleg a májban és a lépben, felhalmozódik túl sok vas a szervezetben, például, gyakori vérátömlesztés.
Cöruloplazmin - a2 -globulinovoy fehérje frakciót a szérum, a molekula 6 - 8. rézionok. Katalitikus aktivitás katalizálja az oxidációs reakció a Fe 2+, hogy Fe 3+. Ez lehetővé teszi, hogy kötelező érvényű a vas transzferrin és az azt követő szállítás a vérben.
Szerkezete és funkciója glikoproteinek. Immunglobulinok.
3.3.1. A glikoproteinek - tartalmaznak, mint prosztetikus csoportot és egy szénhidrátok és ezek származékai. Ezek csatlakoznak vagy N-glikozidos kötés az amidcsoportok aszparagin maradék vagy O-glikozidos kötés az hidroxilcsoport szerin vagy treonin. Szénhidrát alakzatnak van egy szabálytalan szerkezetű.
A glikoproteinek a szervezetben működtetni az alábbi funkciókat: szerkezete (kollagén, elasztin), protektív (antitestek, interferonok), receptor, hormon (agyalapi hormonok), enzimes, szállítás.
3.3.2. Az immunglobulinok (antitestek) - csoport, a fehérjék a szervezet által termelt válaszul a bebocsátást a szervezetbe idegen struktúrák (antigének). Ezek szintetizálják a B-limfociták vagy plazmasejtek. A test lehet előállítani körülbelül 107 faj immunglobulinok, amelyek mindegyike képes felismerni egy specifikus antigénnel. Minden immunglobulinok öt osztályba soroljuk: IgA, IgG, IgM, IgD, IgE.
Az alapvető immunglobulin szerkezeti egység, vagy monomer formában négy polipeptidláncot, diszulfidkötések, ebből:
a) két azonos nehéz láncot (molekulatömege 53.000 - 75.000 Da), amely a betűk H;
b) két azonos könnyű láncot (molekulatömege körülbelül 23.000 dalton), amelyek jelölése a betűk L.
Immunglobulin G, D és E a szerkezetükben, általában a monomerek, IgM-molekula, amelyet öt monomerekből, IgA lehetnek monomerek vagy amelyek két vagy több szerkezeti egységet.
Protein láncok alkotják az immunglobulin, osztható specifikus domének vagy régiók, amelyek bizonyos szerkezeti és funkcionális jellemzőkkel.
N-terminális részei mind az L-, és H láncokat úgynevezett variábilis régió (V), mint a szerkezet jellemzi lényeges eltérések között az antitestek különböző osztályainak. Belül a variábilis dómén három hipervariábilis régiók, amelyek különböznek a legnagyobb diverzitás az aminosav-szekvenciát. Ez egy antitest variábilis régió felelős a kötődés antigének a komplementaritás elvét; elsődleges szerkezete fehérje láncok ebben a régióban meghatározza specificitását az antitestek.
C-terminális doménjei H- és L-láncok rendelkeznek viszonylag állandó elsődleges szerkezete valamennyi osztályán belül antitestek úgynevezett konstans régió (C). A konstans régió határozza meg a tulajdonságait a immunglobulinok különböző osztályainak, eloszlásuk a szervezetben, részt vehet a kiváltó mechanizmus okozza a pusztulását antigének.
3.3.3.Funktsii immunglobulinok. IgG alkotják mintegy 75% a teljes plazma immunglobulin. IgG hatékonyan kötődnek és inaktiválják az idegen molekulák és sejtek csapdába a szervezetben, és szintén megkönnyíti a későbbi megsemmisítése, képesek leküzdeni a placentán, amely immunitást a csecsemőknek az első hét során.
IgA tartalmazott főleg a nyálkahártya a légúti váladék és kiválasztó traktus, a gyomor-bél traktus, azaz védi a felületet kommunikál a külső környezet.
IgM szintetizált a korai szakaszában az immunválasz, adja meg az agglutinációs reakció antigénekkel, aktiválja a komplement rendszert.
IgD társított limfocita membrán funkció receptorok az antigének.
IgE részt vesz a fejlesztés az allergiás reakciók elleni védelem parazitás.
3.4.1. Közül chromoproteins megkülönböztetni hemoproteins (tartalmaznak prosztetikus csoportot a porfirin származékok) és flavoproteinek (származékokat tartalmazó riboflavin - B 2-vitamin). Chromoproteins részt vesz számos létfontosságú funkció, mint például a szöveti légzést, oxigén-transzfer, redox reakciókat, fény érzékelése, a fotoszintézis a növényi sejtekben, és egyéb folyamatok.
3.4.2. By hemoprotein közé hemoglobin, mioglobin, citokrómok, peroxidáz, kataláz. Ezek a fehérjék tartalmaznak hem mint prosztetikus csoportot.
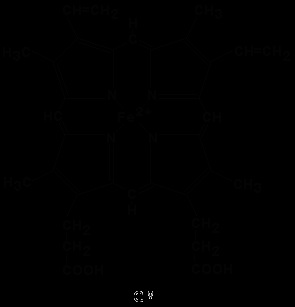
A kémiai szerkezete hem egy protoporfirin IX. társított vas. Protoporfirin IX - egy szerves tartozó vegyület az osztály a porfirinek. Protoporfirin IX négy szubsztituált pirrol gyűrűk összekötött metin hidak = CH-. A helyettesítő csoportok pirrol gyűrűk a négy metil-csoport CH 3 -. két vinilcsoport CH2 = CH-, és két propionsav maradékot - CH 2-CH 2-COOH. Hem kötődik a proteinhez, részt a következőképpen. Apoláros csoportok. protoporfirin IX kölcsönhatásba hidrofób aminosav helyek alkalmazásával hidrofób kötések. Továbbá van egy koordinációs kötés között a vas-atom és a radikális imidazol hisztidin a fehérje lánc. Egy másik koordinációs kötést a vas atom lehet használni, hogy megkötik az oxigént és más ligandumok.
A jelenléte a biológiai anyag a hem-tartalmú fehérjék alkalmazásával detektáltuk benzidin minta (ha hozzá benzidin és hidrogén-peroxid a vizsgálati oldat elszíneződött cián).
3.4.3. Hasonlítsuk össze a szerkezete és funkciója a hemoglobin és a mioglobin, memorizálja a jellemző vonásait ezen fehérjék.
Mioglobin - kromoprotein jelen van az izomszövetben, és amelynek nagyobb az affinitása az oxigén. A molekulatömeg e protein mintegy 16.000 Igen mioglobin molekula egy tercier szerkezete, és egy egyetlen polipeptid-lánc, csatlakozik a hem. Mioglobin nincs alloszterikus tulajdonságokkal (lásd. 2.4.), A görbe telítettségi oxigénnel van formájában hiperbola (4. ábra). Mioglobin funkciója az, hogy hozzon létre egy tartalék oxigén az izmok, amelyek fogyasztják szükség, töltő ideiglenes oxigénhiány.
Hemoglobin (Hb) - kromoprotein jelen eritrociták, és részt vesz a közlekedési oxigén a szövetekbe. Hemoglobin felnőttek úgynevezett hemoglobin A (Hb A). A molekulatömege ez körülbelül 65.000 Da. Hb-molekula kvaterner szerkezete, és tartalmaz négy alegységből - polipeptid-láncból (kijelölt α 1. α 2. β 1 és P 2. minden egyes társított hem.
Vegye figyelembe, hogy kifejezés jelentése olyan hemoglobin allosztérikus fehérjék, annak molekulák reverzibilisen változik egyik konformációban a másikba. Ez megváltoztatja a fehérje affinitás ligandumok. A konformációban a legalacsonyabb affinitása egy ligand úgynevezett intenzív, vagy a T-konformációt. Konformációban a legnagyobb affinitással a ligand nevezett relaxált vagy R-konformációban.
R- és T-konformációja a hemoglobin molekula egy dinamikus egyensúlyi állapot:
Különböző környezeti tényezők eltolódhat, hogy egyensúlyt az egyik vagy másik irányba. Alloszterikus szabályozók, amelyek befolyásolják az affinitása Hb O 2: 1) oxigénatom; 2) a koncentráció a H + (pH); 3) A szén-dioxid (CO 2); 4) 2,3-difoszfoglicerát (DPG). Csatlakozási oxigén molekulák egyik alegységet hemoglobin megkönnyíti az átmenetet a nyugodt feszült konformációját és növeli az oxigén iránt affinitást mutató más alegységek az azonos hemoglobin molekula. Ezt a jelenséget nevezzük kooperatív hatást. A komplex jellege kötődését hemoglobin oxigénnel jelentése a hemoglobin telítési görbe O 2. rendelkező S-alakú (3.1 ábra).
Tartalmának növelésére CO + H2. FGD a háttérben az alacsony O 2 parciális nyomását a szövetben elősegíti a kölcsönhatás ezen tényezők a hemoglobin és elmozdulás konformációjában az R-T-konformációt. Ez vezet elmozdulás az egyensúlyi egyenletben (1) jobbra. Az elválasztott O 2 a szövetbe.
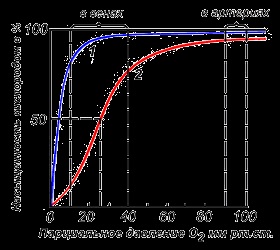
3.1 ábra. Görbék telítettsége mioglobin (1), és a hemoglobin (2) az oxigén.
3.5.1. Feladatok.
1. A fehérje hidrolizátum komplex detektált foszforsav. Hogy lehetséges-e elegendő bizalmat megmondani, hogy mi osztály tanult fehérjét?
2. Hasonlítsd össze a prosztetikus csoport hemoglobin oldódnak vízben és szerves oldószerekben.
3.5.2. Szabványok megoldásokat.
1. Amint az a 3.1 táblázatban, foszforsav a prosztetikus csoport fehérjék foszfoproteinek osztályban. Az is ismert, hogy a foszfát szerepel a nukleinsavak, amely működhet, mint egy prosztetikus csoportot nukleoproteineket. Ezért, a foszforsav lehet detektáltuk a hidrolizátumban a foszfoprotein, vagy nukleoprotein. Hogy tisztázza a hidrolizált fehérje osztály meg kell tölteni minőségi hidrolizátum reakció nitrogéntartalmú bázis és pentóz (vö. 3.1.).
2. Az az anyag oldhatóságát vízben vagy szerves oldószerekben attól függően, milyen funkciós csoportokat túlsúlyban a molekulában. Prosztetikus csoportjának hemoglobin - hem - csak két poláris csoportot (két karboxil-csoportokat), a többi nem-poláros molekulák (egyenletes elektronsűrűség eloszlás). Ezért hem nagyon jól oldható szerves oldószerekben és vízben oldhatatlan (lásd. 3.2.).
3. 2, 3-difoszfoglicerát (DPG) egy allosztérikus szabályozója csökkenti a hemoglobin affinitását oxigént. Ezért növelésével tartalma DPG a vörösvértestekben az egyenletben a disszociációs egyensúlyi HbO 2 jobbra tolódik. Fokozott oxigén felszabadulását oxihemoglobin van kompenzációs értéket a szervezet számára, hiszen kitölti elégtelen oxigénellátás a légkörből (lásd. 3.2.).