Katalitikus folyamatok szerves klórtartalmú szintézis (II rész)
KATALITIKUS eljárásokkal számos A szerves klórtartalmú (II rész)
folyamatok oxiklórozásból
Katalitikus folyamatok oxiklórozó telített és telítetlen szénhidrogének C1-C3, amelyek a fő felhasználási területének hidrogén-kloridot és meghatározó az egyensúlyt a klór. Elemeztük a kinetikus minták és a technológiai folyamatok előállítására klórmetán, diklór-etán és a vinil-klorid, allil-klorid. Módjai szakember számára a szerves klór hulladékot feldolgozó eljárás oxiklórozó és a hidrogénezést biztosítva teljes kihasználását a szénhidrogén nyersanyag.

I. reakcióvázlat konjugálása oxidációs reakció hidrogén-klorid
egy helyettesítő klórozási reakciót telített szénhidrogének:
Reakcióvázlat II. Konjugációs reakciók (1) és (2) az I. reakcióvázlat dehidroklórozási reakciót korlátozó klórozott szénhidrogének.
Reakcióvázlat A III. Reakció összekötő oxiklórozási telítetlen szénhidrogének.
Reakcióvázlat IV. Szubsztitúciós reakcióját oxiklórozási telítetlen szénhidrogének.
Figyelembe véve azt is a mellékreakciók mély oxidáció mono- és a szén-dioxid, arra lehet következtetni, hogy az oxiklórozási szénhidrogének összetett többutas eljárási körülmények, amelyek kell kiválasztani a feladattól függően.
Az alapot a oxiklórozási eljárás szolgált a gázfázisú reakcióban a hidrogén-klorid oxidációs nyitott Deacon 1868-ban.
A oxidációja hidrogén-klorid klórrá - reverzibilis reakció, amely akkor fordul elő általában a hőmérséklet körülbelül 400 0 C-on A függőség a egyensúlyi állandó a hőmérséklet [4]:
Az értékek Kp és mértékét O2 és a HCl konverzió jelentősen csökken növekvő folyamat hőmérséklete. Növekvő oxigénfelesleg, és a nyomás emelkedése növekedéséhez vezet a konverziós foka HCI és Cl2 tartalom a reakcióelegyben, de a hőmérséklet a tartományban 600-700K, amikor a folyamat sebessége elegendően nagy, az egyensúlyi sósav átalakulás eléri a 90%.
Amikor a kombinált áramlás Deacon reakció (1) és a klórozás (2) (2 1) a reakció egyensúlyi eltolódik fogyasztása miatt a klór, amelynek lehetnek csaknem teljes konverzióját HCI. Emiatt az összes oxiklórozási reakció alkánok, alkének, és azok klórozott gyakorlatilag visszafordíthatatlan az üzemi hőmérséklet-tartományban [5].
Általánosan elfogadott szempontból, amely szerint a magas hőmérsékletű oxidációnak, és HCI oxiklórozási katalitikusan aktív komponensek általában keveréke réz-klorid és alkáliföldfém-elemek felületén a hordozó olvadt állapotban. A megjelenése réz-kloridot, mint a bevezetése alkálifém-kloridok, csökkenéséhez vezet olvadási eutektikum használt katalizátorok.
Alapján a teljes Deacon reakció sémát javasoltak, és adszorpciós kinetikai vizsgálatok hlormednyh katalizátorok jelenlétében [3, 6, 7]:
Ez az ábra megfelel az alábbi kinetikai egyenlettel:
ahol K - egyensúlyi állandó termikus disszociációja a réz-klorid;
k - állandó oxigén adszorpciós arány.
A kapott adatokat használjuk, hogy tanulmányozza minták oxiklórozási telített szénhidrogének - metán és etán.
HCI-oxidálási jelenlétében metán szerint járunk kinetikai törvények létre a Deacon-eljárás, azaz függetlenül a jelenléte a reakcióelegyben klórmetán. Egy másik funkció azonosították egységesítés kinetikáját képződésének klórmetán oxiklórozásban reakciók és a direkt klórozási jelenlétében CuCl2 -KCl rendszer. Mindkét reakciót jellemzi elsőrendű kinetikus metán, frakcionált klór- és gyakorlatilag azonos értékeit az aktiválási energia (113 kJ / mól). Sebesség oxiklórozó és klórozással lehet által leírt egyenlettel az erejét a forma, ahol a sorrendben oxigén változik 0-0,25 [3, 8, 9].
Oxidációs jelentése HCI teljes térfogatában az olvadék a katalizátoron, míg a reakció a metán klórozásával és klórmetán, és a oxidációs - a fém felületére. Továbbá, ezek a reakciók mennek végbe a különböző aktív helyek, és a jelenléte átmenetifém-kation a központok, amelyek klórozás nem szükséges. Klórozási reakciót metán és 425 0 C történik túlnyomórészt heterogén mechanizmust, míg magasabb hőmérsékleten uralkodó esetlegesen heterogén mechanizmus homogén másodfokú láncterminációs klórral.
A technológiai folyamat a oxiklórozási metán clearance lehetnek különböző, a fluid ágy vagy rögzített ágyas. A kettő kombinációja kiviteli alakok, amely a hő hatékonyabb elvezetését, és a magas konverziós kiindulási anyagok.
Néhány kilátások képviseli a lehetőségét ipari folyamat végrehajtásának az oxiklórozási etán, hogy a kívánt terméket közvetlenül - vinil-klorid. A csúcs a kutatás ebben az irányban jött az 70-én - 80-én éves a huszadik század, és már tele van jelentős olcsó a földgáz, mint a kórosan magas olajárak nyersanyagok időszakban.
Mivel a tudományos és alkalmazási szempontok érdeklődés geterogennokatalitichesky, gázfázisú eljárás az oxiklórozási etán. A folyamat játszódik le jelenlétében a hagyományos katalizátorok Deacon - réz-kloridot adalékok inert hordozóra. Attól függően, hogy az eljárás körülményei, a kialakulását számos klórozott származékai etán és etilén. A preferenciális kialakulását a vinil-klorid előnyösek magas hőmérséklete 400-550 0 C
Amint az oxiklórozási metán, a klór képződése és az azt követő klórozással folyamatok fordulnak elő különböző aktív helyek. A oxiklórozási etán és a klór-származékok etán-etilén sorozat egy komplex heterogén-homogén eljárás eljárásban keresztül több párhuzamos-szekvenciális lépéseit klórozás dehidrokiórozó, és követi klórmentesítést reakciók mély oxidációja a kiindulási anyagok és intermedierek. Az általános rendszer konverziók etán a következő [10]:
homogén homogén, heterogén heterogén
homogén ↓ ↑ homogén
Az eljárás végrehajtása során hőmérsékleten 500-550 0 C fő termékek az etilén és a vinil-klorid, teljes kitermelés 80% -át eléri [11]. A csökkenés mértéke az etán nem HCI függ a parciális nyomás és jól leírja a következő egyenlet [12]:
Hasonlóképpen engedelmeskedik törvények és a sebesség elvesztése klórozott metán kivételével 1,1-diklór-etán.
A folyamat során a oxiklórozási etán fordulnak elő, mint mellékreakció oxidációs klórozott szénhidrogének és alkotnak szén-oxidok. A oxidáció sebessége által leírt egyenlettel:
A fő hozzájárulása a képződési sebességét mély oxidációs termékek hozzájárulnak telítetlen vegyület [13]; ahol az adagolás egy klóratomot a molekulában drámaian (7-8-szor) növeli az oxidáció sebességét. További mennyiségének növekedése klóratomok csökkenti a hozamát COx termékek: tri- és tetraklór-etén lényegében nem oxidáljuk a folyamat feltételei között. A legjobb technológiai indexek által elért a folyamat katalizátorok alkalmazásával CuCl2 -KCl / hordozó, a fajlagos felület nem haladhatja meg a 10 m 2 / g. Szelektivitás vinil-klorid folyamat 35-40% egy konverziós etán
95% [14]. Ezeken értékek az átalakítás a reagensek és a vízgőz jelenlétében (az egyik eljárás termékei) zajlik szekunder átalakítására: hasznosítás a vinil-klorid, hogy etilén és acetilén, hogy a szén-monoxid.
Annak ellenére, hogy a mély tudományos és technológiai kidolgozása feldolgozza oxiklórozásban metán és etán ipari körülmények között még nem hajtották végre.
Ennek az az oka a magas beruházási együtt csökkent a kereslet a klór (release széntetrakloridot általában tiltja a montreali jegyzőkönyv 1987). Közvetlen átalakítás etán alkotnak vinil-kloridot, majd bóng nagyobb mennyiségű hulladék, mint a „etilén” folyamat. Szerepet játszik továbbá bólshaya rendelkezésre álló nyersanyagok az etilén (benzin, gázolaj) az európai országokban.
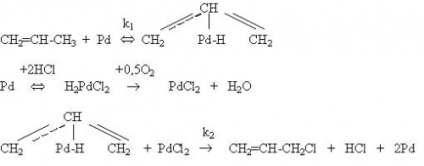
Tól oxiklórozási eljárásoknál a legtöbb gyakorlati jelentősége oxidatív klórozása etilén előállítására 1,2-diklór-etán, mint a kulcslépés egyensúlyban áramkör vinil-klorid gyártása. Az oxidatív klórozási etilén bevételt tartalmazó katalizátorok CuCl2. lényegesen alacsonyabb (200-3000S) hőmérsékleten, mint feldolgozza Deacon vagy oxiklórozási telített szénhidrogéneket, és nem tartalmazza azt a lépést HCI oxidáció. A mechanizmus tartalmaz oxiklórozási etilén lépésben reakció CuCl2. amelyben a redukált réz képződjön:
Cl Cl Cl Cl Cl ClC2 H4 Cl Cl / / / / Cu Cu Cu Cu (1a) (1) - Al - O - Al - O - Al - + C2 H4 ® - Al - O - Al - O - Al - ® | | | | | | Cl Cl | | Cu Cu (1c) ® - Al - O - Al - O - Al - + C2 H4 Cl2 (1) | | | Cl Cl Cl O Cl | | / / (I) Cu Cu Cu Cu (1c), (2a) - Al - O - Al - O - Al - + ½ O2 ® - Al - O - Al - O - Al - (2) | | | | | | Cl O Cl Cl Cl Cl Cl / / / / Cu Cu Cu Cu (2a) (1a) - Al - O - Al - O - Al - + 2 HCI ® - Al - O - Al - O - Al - + H2 O ( 3) | | | | | |
Együtt réz katalizátorok oxiklórozási etilén vihetünk promoterek vagy stabilizátorokat, fém-kloridok, mint például lantán, magnézium, kálium, és mások. Ez egyrészt növeli a képességét, a kationok a réz, hogy a koordinációs kötési olefinekkel, másrészt, csökkentheti az aránya mellékreakciók, különösen mély oxidációs reakciók [15, c.79].
Melléktermékek során oxiklórozási etilén lehet két csoportra oszthatók:
1. Side szerves klór termékek, amelyek magukban foglalják a legtöbb klór-szubsztituált C1-C2 szénhidrogének, mint a paraffin és olefin-sorozat;
2. mély oxidációs termékek - CO és CO2.
Tekintettel arra, hogy a szén részaránya oxiddá akár 70% az etilén alakítjuk melléktermékek, hogy tanulmányozza a feltételeket azok kialakulása fontos alkalmazás. Jelenik [23], hogy a képződési sebességét COx termékek által leírt egyenlet típusa:
ahol i - etilén vagy diklór-etán, a diklór-etán oxidációs sebesség durván kétszer az oxidáció sebességét etilén.
Oxidáció és etilén-diklorid történik többnyire a aktív centrumok tartalmazó CuCl2 fázis és Cu2 (OH) 3 Cl, viszonyítva feleslegben a kölcsönhatás a hordozóval [24,25]. Figyelembe aktív formáit a réz aktív helyek mély oxidációs reakciókat, úgy véljük, hogy a rendszerben (I) forma a réz reoxidációs reakcióval (2) felé irányuló koordinatív kötés egy hordozót, oxidálja a szerves szubsztrát. Az oxidációs reakció verseng reakció (1) a fenti rendszer, amely megmagyarázza, HCI gátló szerepet oxidációs reakciókban.
Az általános rendszer a szén-oxidok, a folyamat a következő
[23]: C 4H 2 → CH2 CiCH 2CI → CH 2 3 ClCHO → CCl CHO I II III SO 2 ↓ CO
A sebesség aránya útvonalak oktatási termékek CO x r1. r2. r3 = 1: 2: 0,3
A kapott adatokat a tanulmány a katalizátor szerkezetét és annak hatása a kinetikus és a folyamat paramétereket alkalmaztuk fejlesztésére ipari eljárás etilén oxiklórozási.
Minden etilén oxiklórozási eljárásoknál lehet osztani két fő jellemzői: a használata a légköri oxigén vagy tiszta oxigént, és a használata egy fluidágyas vagy rögzített ágyas. Az 1. táblázat mutatja a jellemzői a legfontosabb ipari oxiklórozásból folyamatokat.
1. táblázat Jellemzői ipari oxiklórozási folyamatok.
allil-klorid termelési sebesség lehet a következő egyenlet szemlélteti:
Katalizátorok fontos szerepet játszanak a elvének megvalósítása a kiegyenlítő folyamatok szénhidrogén nyersanyag. A legígéretesebb az, hogy az ipari folyamatok oxiklórozási klórozott C2 - C3 így tri- és perklór-etilén és ezek szelektív hidrogénezéssel, etilén és propilén, illetve, és visszatérésüket a termelési ciklust.
Oxiklórozó klórozott C2 - C3 végezzük jelenlétében g réz és kálium-klorid, legalul egy porózus hordozót. Előnyösen alkalmazható hordozóanyagok kis fajlagos felülete (10-15 m2 / g), hogy csökkentse a melléktermékek képződése mély oxidáció [30,31]. Úgy találták, hogy feletti hőmérsékleten 350 0C, média áramlik a réz oxidációs reakció a hidrogén-klorid a klór és az utóbbi része a további átalakítások. oxiklórozására 1,2-diklór-etán sebességet egyenletben leírt (hasonlóan elfogadott oxiklórozási alkének [32]):
:
Ezáltal a kiegyensúlyozott folyamat betáplált szénhidrogén.
hidrogénezési eljárás is használható a feldolgozó a szén-tetraklorid, a kibocsátás a által tiltott a montreali jegyzőkönyv 1987. kloroform: CCI 4 + H2 ® CHCI 3 + HCl
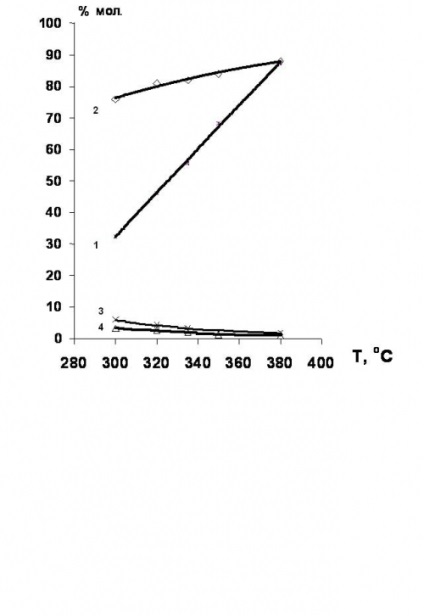
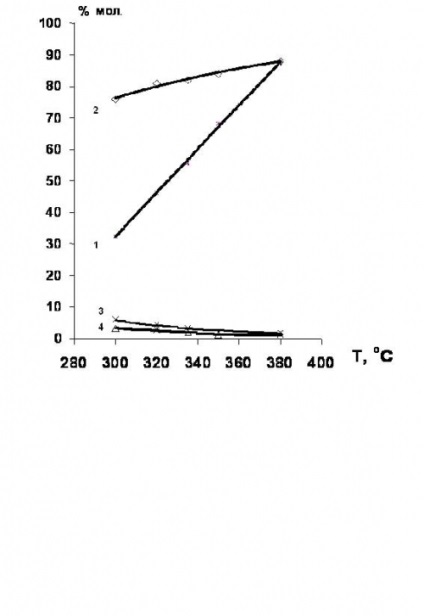
Alapítva [34,35], amely hidrodeklórozása klórozott etán-etilén-sorozat célszerűen jelenlétében nikkel-tartalmú katalizátorokat. a hozam etilén ebben az esetben eléri a 80% (4. ábra).
Palladium a katalizátorok aktívabbak, de kevésbé szelektív, mint a nikkel: főtermék ebben az esetben etán, amelynek kimenete eléri a 70%, és a kitermelés az etilén nem haladja meg a 10-15%.
Ahogy azt már kimutatták [34], ez előnyösen hidrodeklórozás mechanizmust feltételezve multiplett elválasztása klóratomok egy molekulából a kiindulási vegyületet. Hidrodeklórozása reakciósebesség fejezi ki a következő egyenlettel:
Reaktivitás chloroolefins ahol alacsonyabb, mint klóralkánok [35].
Iparilag, az eljárást kell végezni egy fix ágyas katalizátort cső alakú reaktor alkalmazásával. A hőmérséklet 320-370 0 C, az érintkezési idő 5-10 másodperc, a mólarány a hidrogén-per-atom klór 0,5: 1.
A katalizátort erre a célra kifejlesztett eljárásnak van egy nagy stabilitású.
A feldolgozás a szekunder hulladék, mint például hexaklór-benzol, hexaklór-etán, és mások. Célszerű felhasználni palládium katalizátor. Obeskhlorennye biotermékek küldik tovább az égés, és a hidrogén-klorid is hasznosítható a folyamatban.
Következtetés.
Ipari érték organoklorin szintézis folyamatok eredményeként nőni fog a jövőben. Ez annak köszönhető, hogy egyre nagyobb szükség van, az integrált használata ásványi és szerves anyag, amely ebben az esetben, az olyan só termékeket és újrahasznosítás olaj és földgáz. Ennek szükséges feltétele, ez minimális hatással van a környezetre. Az ezen elv végrehajtásával kell megvalósítani, legalábbis a két irányban:
1. létrehozása folyamatok, teljesen szimmetrikus klór és szénhidrogén nyersanyag;
2. A rendelkezésre álló képzett, környezetbarát technológia a feldolgozási hulladék termelés és fogyasztás szerves klórtartalmú termékeket.
1. ábra. Lg függését a reakció sebességi állandója értéke # 61508; H M-Cl kötést.
_____ kísérleti adatok
------- becsléseket
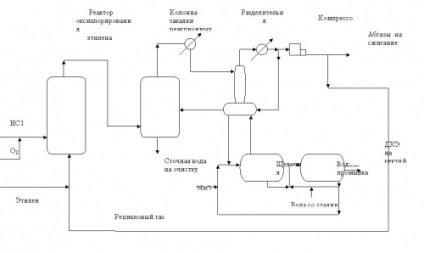
2. ábra. Folyamatábra a folyamat oxiklórozó etilén egy fluid ágyas katalizátor
3. ábra. Folyamatábra a folyamat oxiklórozó etilén egy fix ágyas katalizátort.
4. ábra. Hőmérsékletfüggése a konverzió 1,2-diklór-etán és a szelektivitását a hidroklórozása termékek jelenlétében egy Ni-tartalmú katalizátorok.
1 - a konverzió 1,2-diklór-etán;
szelektivitás: 2 - etilén; 3 - etán; 4-etil-klorid