beadunk egy kémiai kötés Nature
Kémiai kötés a tartó erőt együtt két vagy több atomok, ionok, molekulák vagy ezek bármely kombinációjával. Jellegéből adódóan ez egy elektrosztatikus vonzóerő között a negatív töltésű elektronok és pozitív töltésű atommag. A nagysága ezt a vonzó erő függ főleg a külső héj elektron konfiguráció az atomok (lásd. Ch. 1). Például, a nemesgázok, nehéz alkotnak kémiai kötéseket, mert van egy stabil külső elektron héj. Ezzel szemben az elemeket, amelyek az atomok a külső héj csak egy elektront, könnyen kémiai kötést alkot. Egy példa az ilyen elem jelentése hidrogénatom.
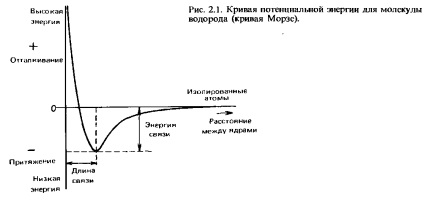
Amikor két hidrogénatom egymáshoz közelítenek egy kis távolságra, ezek vonzzák egymást. Azonban, ha a megközelítés túl sok is van, taszítás között. Az optimális egy távolság, amelynél a vonzás és taszítás erők egyensúlyban. Ez a távolság Ha a potenciális energia minimum két kölcsönható atom. Ezt a távolságot nevezzük kötéshossz. Vissza fogunk térni a részletesebb tárgyalását ebben a fejezetben. Ha ábrán. 2.1 ábra a függőség a potenciális energiája közötti távolság a magok. A görbe ilyen típusú nevezik Morse görbe. Az való elválasztásához szükséges energiát a két kapcsolódó atom, és távolítsa el őket egymástól egy távolság, amelyen már nem érzi, az erő a vonzás egymással nevezik a kötési energiát, illetve az energia a disszociációs a kommunikáció. A kísérleti meghatározása végzi mérésével entalpia kapcsolatot (ezt a kifejezést találkozunk fejezetben. 5).
Az a képesség, atommal kémiai kötések nevezett vegyértékével. Azonban ez a fogalom tekinthető elavult, mivel jelenleg sokkal szokás tekinteni kémiai kötés nem általános, de figyelembe véve a konkrét típusát. Az elektronok prshshmayuschie kialakításában játszik szerepet a kémiai kötések, amelyek az úgynevezett vegyérték elektronok. Ezek az elektronok a legmagasabb energia pályák az atom (lásd. Ch. 1). A külső héj az atom, amely tartalmazza ezeket pályák az úgynevezett vegyérték-héj.
Elektronikus Theory valentnosti.Sovremennye ötlet a természet a kémiai kötés alapján a vegyérték-elektron elmélet. Ezt az elméletet függetlenül alakult G. N. Lewis és B. Kossel 1916-ban, mint egy vegyérték-elektron elmélet atomok, amely egy kapcsolatot közelebb elérése a legstabilabb (vagyis olyan, amelynek legkisebb energia) elektron konfiguráció. Az atomok lehet elérni ezt a két módja van:
1. Lehet menteni, vagy szerezhet elektronok alkotnak ionokat. Ha atomok megszerezni elektronokat, ezek alakítjuk anionok. Ha elvesztik elektronokat, majd alakítjuk kationok. Anionok és a kationok egy kitöltött külső elektron héj egy stabil elektronikus konfiguráció. Között az anion és a kation történik egy kémiai kötés, amely az elektrosztatikus vonzóerő. A kémiai kötés az előbbiekben nevezett electrovalent kötés; A modern neve ionos kötést.
2. atomok is szerezhet stabil külső elektronikus konfigurációk megosztásával az elektronok. Ez akkor fordul elő, ha a kémiai kötés nevezzük kovalens kötés. A kovalens kötés által alkotott pár elektronok szolgáltatott egyik minden egyes atom. Azonban bizonyos összetett ion, molekula vagy két ilyen elektronok által szállított csak egy atom. Ez a fajta kovalens kötés az úgynevezett koordinációs, donor-akceptor, vagy dativus kovalens kötés.
Oktett szabályt. Ha egy atom bármely elem képez egy kémiai kötés, egyre, elveszti, vagy társasági vegyérték elektronok, az elektron konfiguráció azonos lesz, hogy a nemesgáz atom található végén ugyanabban az időszakban, mint az aktív elem, vagy a végén az előző időszakban. A atomok a nemesgáz, kivéve a hélium, van a külső héj rezisztens oktett (nyolc) az elektronok. Ezért, a formáció a kémiai kötések által érdekében stabil elektronszerkezet mint az atomok a nemesgázok, a lényege az úgynevezett oktett szabályt. Ez a szabály vonatkozik ionos és a kovalens kötés.
Más típusú kémiai kötéseket. Egy különleges eset a kémiai kötés fémek; nem lehet tulajdonítható ionos típusú, vagy egy kovalens kötés. A szilárd állapot fémek áll pozitív töltésű ionok, szorosan csomagolt a kristályrácsban, és tartanak össze szabad elektronok, amelyek „lebegnek” körül az ionokat „elektronikus tengeri.” Ez a típusú csatlakozás az úgynevezett fém kötőanyagot.
Van még két típusú kémiai kötéseket, ami szintén figyelembe kell venni ebben a fejezetben. Ez - a hidrogénkötést és van der Waals-erők. A kapcsolat a két típus lényegesen gyengébb, mint a más típusú kommunikáció.