Típusai hibridizációk és geometriai konfiguráció egyes komplexek
2. ábra. Hasítás d AOS a ligandum területen teraedricheskom
Az energia mennyisége JSC dg és d # 949; sorozat a törvény szerint az energiamegmaradás egyenlő a kezdeti érték az energia E0 degenerált pálya. A különbség az energiáit az új energia sublevels nevezett (egy másik opció) hasítás. A felosztása az energia komplexképző ligandum határozza meg a természet.
3D-elemek kísérletesen létrehozott ún spekrtrokémiai sorozat. ahol a bal oldali számérték # 916; monoton növekszik:
I -
<–N CS – (Az aláhúzott atom közvetlenül kapcsolódik a komplexképző szer) Ligandok bal oldalán (gyenge mező ligandumok) előállítása alacsony energiájú hasítási d # 8209; szintalatti. Ebben az esetben az # 916; nem haladja meg az energia kölcsönös taszítása párosított elektronok, ami a töltés AO elektronok szabálynak megfelelően Gunda (lásd. ábra. 3).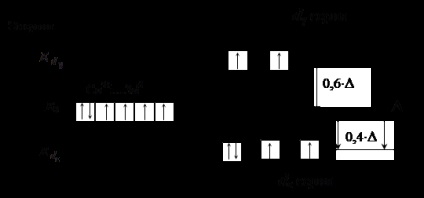
3. ábra. A elektronok eloszlását a d -podurovnya Co 3+ ion
oktaéderes elrendezés gyenge ligandum területén
Ligandok oldali részét (egy erős mező ligandumok) vezet jelentős energia hasító d -podurovnya, az értéket # 916; meghaladja az energia az elektron-elektron taszítás párosított elektronok. Ez azt jelenti, hogy az energetikailag kedvezőbbek elektronok töltse JSC megsértve Hund szabály. Például, abban az esetben, hogy egy oktaéderes elrendezés az erős mező ligandumok elektronok kitölti AO először az egyik, majd a második d # 949; sorozat, majd ugyanabban a sorrendben d # 947; sorozat (lásd. 4. ábra). Mert tetraéderes mezősorrend megfordul.
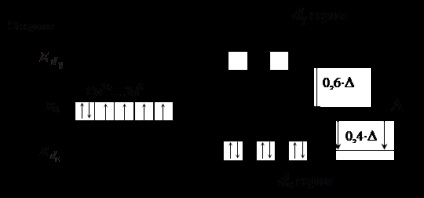
4. ábra. A elektronok eloszlását a d -podurovnya Co 3+ ion
oktaéderes elrendezése erős mező ligandumok
TPL valamint az AIM elmagyarázza a mágneses tulajdonságai a komplexek jelenlétében párosítatlan elektronok - a komplex paramágneses, és ezek hiányában - diamágneses.
Ha d # 947; szintalatti esetében oktaéderes ligandum mező (vagy d # 949; szintalatti a tetraéderes mező) betöltetlen (szabad) a, a komplex ion abszorpciós egy fénykvantum átmenet lehetséges az alsó elektron energia szintalatti a. Az ilyen átmenetek jelenlétének meghatározására a színek a COP, mint az energia az elnyelt kvantum fény egyenlő a hasítási energiát. Az 1 mol az elnyelő anyag kielégítése a összefüggést (J / mol)
,
ahol h - Planck állandó (h = 6,63 × 10 -34 J × s); c - a fénysebesség (c = 3 × 10 augusztus m / s); NA - Avogadro számát (NA = 6, 02 × 23 okt mol -1); l - fény hullámhossza abszorbeált, m.
Ha az abszorpciós a hullámhosszúságú fény egy bizonyos része a spektrum, az anyag színes egy megfelelő színű. Amikor cseréli a komplex ligandumok másikat, amelynek nagyobb a térerő értéke # 916; növeli, és a komplex kezd, hogy felszívja a fénysugarak rövidebb hullámhosszon. Ez megváltoztatja a színét. Például, komplexek réz (II), amelyek az átmenetet [CuCl4] 2+ a [Cu (H2 O) 4] 4+ és [Cu (NH3) 4] 2+ szín változott a kék a zöld, hogy a kék-ibolya.
A jellemző a stabilitás komplexek olyan kifejezések használatosak a stabilitás és a semlegességet vagy labilitás és instabilitást. A stabilitás a komplex termodinamikai tulajdonságai, és együtt jár az energiáit Ennek a kapcsolási és entrópiaváltozás upon komplexképzéssel. Tehetetlenség és fordítva, annak labilitás komplex kinetikai jellemzőkkel függően ligand helyettesítési aránya. Stabil komplexek lehetnek inert és labilis. Például, ionok [Cr (H 2O) 6] 3+ és a [Fe (H2 O) 6] 3+ szoros értékei kötés energia, azaz Ők közel azonos ellenállást, de az első készlet ligandok inert és cserék lassan és második labilis ligandumok azonban cserék gyorsan. Instabil komplexek leggyakrabban labilis.
Amikor vízben oldjuk COP amelynek külső gömb disszociál mind erős elektrolitok, hogy a komplex kialakításához ion álló részecskéket a belső szféra és a külső gömb az ionok. Ezt a folyamatot nevezzük primer disszociációs. például
Ezzel együtt folyamat rendszerint sebességű, reverzibilis disszociációja a belső gömb, amely az úgynevezett másodlagos disszociációs. Így egy ion [Fe (CN) 6] 4-, ez a folyamat a következő lépéseket
első szakaszban [Fe (CN) 6] 4- ↔ CN - + [Fe (CN) 5] 3-
második lépésben [Fe (CN) 5] 3- ↔ CN - + [Fe (CN) 4] 2- stb
A kvantitatív jellemző az erejét a komplex ion a disszociációs egyensúlyi állandó a másodlagos folyamat, amely az úgynevezett instabilitás állandó Knest. Például, az ion [Fe (CN) 6] 4- instabilitása állandóit az első és a második fokozat által kifejezett egyenletek
;
A gyakorlatban gyakran használják a közös instabilitás állandó érték Knest. amely jellemzi a teljes egyensúlyt a másodlagos disszociációs. Például, az ion [Fe (CN) 6] 4-
[Fe (CN) 6] 4- ↔ 6CN - + Fe2 +.
Knest a termék állandó bizonytalanság minden szinten:
Néha, ahelyett reciproka Knest használható - dörzsölésállóság konstanoyi
Ha a komplexek az azonos számú ligandumok, azok stabilitása lehet meghatározni a bizonytalanság állandó teljes: kevesebb, mint Knest. A stabilabb komplex ion.
Összehasonlítás Knest komplexek reagenst, és a terméket (állandó QP) lehetővé teszi, hogy az egyensúly létrehozásához eltolás irányát ligandum kicserélődési reakció az oldatban. Például, feldolgozni
összehasonlítjuk Knest ionok [PtCl4] 2- és [PtI4] 2-. értéke 1 × 10 -16 és 1 × 10 -31, illetve azt mutatja, hogy a komplex iont - a termék sokkal nagyobb stabilitású komplexet - reagenst. Következésképpen a mérleg ez a folyamat erősen jobbra tolódott, vagyis ez a reakció nem játszódik le előrefelé.
Példák problémák megoldása
Példa 1. meghatározzuk a töltési komplexképző vegyület [Co (NH3) 4 Cl2] NO2. Nevezzük a kapcsolatot.
A külső gömb a COP tartalmaz egy anion NO. Ezért, a töltés az egész belső gömb + 1, azaz a [Co (NH 3) 4 Cl2] +. A belső gömb tartalmaz két ligandum NH3-csoport és a Cl -. Az oxidáció mértéke komplexképző jelölt X és az egyenlet megoldásához
+1 = 1 × 0 · x + 4 + 2 + (-1). Ezért X = +1.
Így a COP a komplex kation. Cím szerinti vegyület: kobalt-nitrit dihlorotetraammin (1).
Példa 2. Miért ion [Cu (NH3) 2] + egy lineáris szerkezet?
Határozzuk komplexképző díjat ebben az összetett ion
+1 = 1 × 0 · x + 2. Ezért X = +1.
Az elektronikus szerkezet a ion vegyérték sublevels Cu + 10 megfelel a konfiguráció 3d 4s 4p 0 0. Mivel 3d - alréteg nem tartalmaz megüresedett a kialakulását kötések donor-akceptor mechanizmust (mint savmegkötő szer) a Cu + vegyenek egy 4s és 4P pályák egyike hogy hibridizált típusától sp. Az ilyen típusú hibridizáció (lásd. Táblázat. 1) megfelel annak a lineáris komplex szerkezetét.
3. példa Határozzuk meg a típusát a hibridizációs AO központi ion, és a geometriai komplex szerkezetét [HgCl4] 2-.
Az elektronikus konfiguráció a központi ion Hg 2+. 5d 10 6s 0 0. 6p és elektron folyamatábra lehet az alábbi képlettel ábrázolható
Öt 3d elektronok teljesen elosztott pályák 3d # 949; sorozat mivel hasító energia, amely akkor jelentkezik, ha kölcsönhatásba a ligandumok az erős mező elegendő, hogy maximalizálja a párosítás az elektronok. Ingyenes 3d. 4s pályák és 4R- vetjük d 2 sp3 -hybridization és okozhat oktaéderes bonyolult szerkezet. A komplex paramágneses, mint van egy párosítatlan elektront

5. példa Gyártmány kötés kialakulását energia diagramja a komplex [CrF4] -, és adja meg, milyen hibridizációs.
Elektronikus képletű Cr 3+. 3 ... 3d 4s 4p 0 0 egyfogú ligandum 4d 0. F - forma négy # 963; -bond gyenge mező ligandumok és létrehoz egy tetraéderes területén
Free két 3d. Egy 4S és 4P AO egy komplexképző hibridizált d-SP 2 típusú. az eredmény egy paramágneses komplex tetraéderes konfigurációjú.
6. példa miért ion [CoF6] 3- paramágneses, és az ion [Co (CN) 6] 3- diamágneses.
E-komplexképző képletű Co 3+. ... 3d 6. Az oktaéderes ligand mező F - (gyenge ligandum kitölteni) fordul elő enyhe hasító d- alréteget, ezért az elektronok töltse AO szabálynak megfelelően Gunda (lásd 3. ábra).. Ebben az esetben négy párosítatlan elektront, így az ion [CoF6] 3- paramágneses. A formáció az ion [Co (CN) 6] 3- járó erős mező ligandumok (ion CN -) d- hasító energia sublevels lesz olyan nagy, hogy meghaladja az energia az elektron-elektron taszítás párosított elektronok. Az elektronok tölti JSC Co 3+ ion megsértve Hund szabály (lásd. 4. ábra). Ebben az esetben minden elektronok párosítva, nagyon ion - diamágnesesek.
7. példa Az ionos [Cr (H 2O) 6] 3+ energia felosztása van 167,2 kJ mol -1. Mi a színe a króm vegyületek (III) vizes oldatban?
Annak megállapításához, a színező anyag határozza meg a hullámhossz, amelynél a fényabszorpció
Így, az ion [Cr (H 2O) 6] 3+ elnyeli a fényt a vörös részét a spektrum, amely megfelel a színét a króm (III) zöld.
8. példa Annak megállapítása, hogy az ezüst-szulfid csapadék válik (I) hőmérsékleten 25 ° C-on, ha mix egyenlő térfogatú 0,001 mólos [Ag (CN) 2] -, CN- ligandum azonos nevű koncentrációjú 0,12 mól / dm 3, és kicsapószer-oldatba S2- ion koncentrációja 3,5 x 10-3 M.
Eljárás disszociációja az ion leírható a rendszer
és lerakódás folyamat a következőképpen írható fel
2Ag + + S 2- ↔ Ag2 S¯.
Annak meghatározására, hogy a képződött csapadékot kiszámításához szükséges oldhatósági terméket az ezüst-szulfid ol (Ag2 S) általános képletű
Koncentrációjának meghatározására ezüstionok levelet a kifejezés a komplex ion instabilitás konstans
A könyvtárat válassza ki a konstans értéke a bizonytalanság a komplex [Ag (CN) 2] - (Knest = 1 × 10 -21). majd
Számítsuk ki a oldhatósága terméket a kapott csapadékot
.
A könyvtár kiválasztásához egy táblázatot értéke oldhatósági terméket az ezüst-szulfid (OL (Ag2 S) táblázat = 5,7 × 10 -51), és hasonlítsa össze a számított is. mivel PRtabl <ПРрасчет. то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
9. példa koncentrációjának kiszámításához cinkion tetratsianotsinkata nátrium oldat koncentrációja 0,3 mol / dm 3, felesleges mennyiségű cianid-ionokat oldatban egyenlő 0,01 mol / dm 3.
Az elsődleges disszociációs történik szinte teljes egészében a rendszer keretében
Másodlagos disszociáció az egyenlet
Írunk a kifejezés a folyamat instabilitás állandó
A könyvtár megtalálni az érték a bizonytalanság állandó ion (Knest = 1,3 × 10 -17). A koncentráció a cianid-ionok eredő disszociációja a komplex, sokkal kevésbé koncentrációja bevitt felesleges, és feltételezhető, hogy a [KN -] »0,01 mol / dm 3 koncentráció, azaz CN - ionok. eredményeként jött létre a disszociáció, el lehet hanyagolni. majd
Energia és kémiai folyamatok. 3
Rövid elméleti információkat. 3
Példák problémák megoldásához. 10
Kémiai kinetika és egyensúly. 17
Rövid elméleti információkat. 17
Példák problémák megoldásához. 22
Komplex vegyületek. 28
Rövid elméleti információkat. 28
Példák problémák megoldásához. 39