Izotermák van der Waals és összehasonlítjuk azokat a kísérleti izotermák
Ábra. 52. ábra izotermák gáz Van der Waals erők.
Nagyon magas hőmérsékleten van egy közeli alakot hiperbolák; Ezek izotermák jellemzik gázállapotban egy anyag (majdnem ideális gáz). Csökkentésével a hőmérséklet és a változó alakja az izoterma egy bizonyos hőmérsékleten (kritikus) érzékeli egy inflexiós pontot a görbe. Akár alacsonyabb hőmérsékleten is (szubkritikus) izoterma helyett a vízszintes része, amely megfelel a fázisátmenet folyadék - gőz, van egy hullámos rész (ábra. 53).
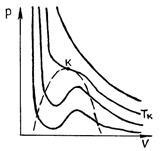
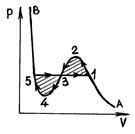
P és p. 52 P és c. 53
A mérések azt mutatják, hogy az izotermák valós anyag lényegében egybeessenek a izoterma van der Waals-erők a területeken (gázállapotú) és (cseppfolyóssá). Azonban ahelyett, hogy a közepén a vízszintes rész 51 megfelelő a fázisátalakulás a folyadék - gőz izoterma Van der Waals van egy hullámos része. Ez hullámzó rész jellemzi a következőképpen. Plot 12 megfelel egy metastabil állapot a gőz (telített gőz), egy része 54 - mint metastabil folyadék (túlhevített folyadék). 1. pontjában nemrég telített gőz, és 5 - csak forrásban lévő folyadékot. Tekintettel a hullámforma részét 234, fizikailag megvalósíthatatlan, mivel a természetben anyagok, amelyekre állandó hőmérséklet-emelkedés vezetne nyomásnövekedést. Ez csak akkor lehetséges, ha a hőmérséklet ezen a területen nem állandó. A túltelített gőz (12 rész) - gáz halmazállapotú anyag, amelyben a p nyomás nagyobb, mint a telített gőznyomást egy adott hőmérsékleten - lehet kísérleti úton összenyomásával a tisztító gáz nyomás nagyobb, mint a telített gőz nyomása, és ez nem fog kondenzálódni. Állapota túltelített gőz, bár van egy bizonyos stabilitása, de ez kevésbé stabil, mint a két-fázisú állapotban (izobár 135), amelyben, mint tudjuk, néhány az anyag folyékony formában, és részben - formájában telített gőz. Ezért, amikor egy kis külső erő túltelített gőz részben átalakul folyékony és a fennmaradó légnemű telítődik.
A túlhevített folyadék (szakasz 45), - olyan állapot, amelyet az a tény, hogy létezik egy nyomás alacsonyabb, mint a gőznyomást egy adott hőmérsékleten - úgy állíthatjuk elő, elhúzódó forrásban lévő tiszta folyadék, ami a folyékony eltávolítjuk gázbuborékok (párologtatás központok), és a folyadékot hőmérsékletre melegítjük, forráspontja fölé egy adott nyomáson. Feltétel túlhevített folyadék is kevésbé stabil, mint az egyensúlyi állapotban a folyadék és a telített gőz. Ha egy ilyen túlfűtött folyadék kerüljön a részecskék idegen anyag, akkor gyorsan saját kétfázisú állapot.
Álló telített gőz és túlhevített folyékony eszközökben használt Nukleáris Fizikai (felhő kamra és buborékkamra) rögzítésére és mérése részecske paraméter.
Ha izoterma Van der Waals hullámos része helyett egy vízszintes vonal 135, majd az izoterma kapunk lesz minőségileg helyesen leírni, és kétfázisú állapotban anyag. A helyzet ezen a vonalon lehet meghatározni, ha egy zárt reverzibilis ciklus 1234531 termodinamika második törvénye alkalmazható a felvétel Clausius (2.13.7):
Mivel az út mentén 1234531 lévő anyag hőmérsékletét marad (mert ez az út épül fel szakaszainak két lehetséges változata az azonos izoterma), az utolsó egyenlet felírható
Behelyettesítve az arány értéke az első főtétele és az a tény, hogy a
megkapjuk a helység ciklus:
Csináljuk az utolsó egyenlőség nyilvánvaló átalakulás
t. e. 135 vízszintes vonal kell tölteni úgy, hogy kikelt látható. Area 53 egyenlő.
Mint már említettük, a kritikus pont izoterma egy inflexiós érintő és ezért ezen a ponton el kell végezni arányok
ahol a belépés azt jelzi, hogy a megfelelő származékok számított a paraméterértékek anyag egyenlő kritikus. Írásban egyenlete van der Waals-erők egy
majd kiszámítjuk származékok és egyenlővé őket nullára, akkor könnyen szerezni
A kifejezések (3.6.8-3.6.10), hogy az arány
Ez nem függ az anyag természetétől. A tapasztalat azt is mutatja, hogy a nagysága különböző értékek a különböző gázok, ez egyenlő 0,33 hidrogén oxigén - 0,29, a szén-dioxid - 0,22. Ezek jelentős különbségek értékek és a kísérleti adatok azt mutatják, hogy a Van der Waals erők, ahonnan ezt az értéket kapunk egy közelítő, bár a képminőség változásait halmazállapot továbbítjuk az egyenlet elég jól. Számos kísérlet történt annak érdekében pontosabb állapotegyenlet. Azonban ezek az egyenletek tartalmaznak számos korrekciós tényezők, fizikai értelmében, amely nem tisztázott, mind az egyenlet a van der Waals erők.
A legáltalánosabb formája a módszerek a statisztikus fizika akadémikus Bogolyubov állapotegyenletre kapunk
ahol - az úgynevezett Virial együtthatók, amelyek a hőmérséklet függvényét. Tól Bogolyubov egyenlet, hogy minél nagyobb az értéke a móltérfogat-. minél kisebb a kifejezések száma meg kell fontolni, hogy kapjunk egy kellően pontos eredményt. Amikor minden tagja a hatványsor nulla, és az egyenlet (3.6.12) formáját ölti. .. Ez azt jelenti, ahogy azt várják, a Bogolyubov egyenlet átalakul az egyenlet Mengyelejev - Clapeyron. Virial együtthatók nem lehet kiszámítani pusztán elméleti módszerekkel, és ezért meg kell határozni a kísérleti adatok. Azonban, ez a probléma olyan bonyolult, hogy megfelelőbb, hogy egy egyszerű egyenlet az állam formájában interpolációs képlet, hogy leírja a kísérleti adatok.