Popkov, Puzakov általános kémia
2. fejezet megoldások és diszperziók
Példa Példa 2.7. Milyen mennyiségű hidrogén-klorid-tömegű frakció 36%, sűrűsége 1,179 g / ml érték, ami 250 ml hidrogén-klorid-oldatot kapunk, amelynek moláris koncentrációja 0,1 mol / l?
Megoldás A képlet szerint (2.1) tekintetében a konvertált L (X), azt találjuk, az anyag mennyiségét a hidrogén-klorid előállításához szükséges az oldat kívánt:
l (HC1) = C (HC1) előállítása = 0,1 mol / l, 0,25 mol n = 0,025.
A tömege, amely megfelel ennek mennyiségű anyagot a következő képlettel számítjuk (2.2) képest konvertált m (X) "
/ I (HC1) = „(HC1) L / (HC1) = 36,5 g 0,025 mól / mól = 0,9125 g
Azonos tömegű kell kloriddal, amely 1sya és az eredeti oldatban. A tömeg ezt az oldatot az alábbi képletből (2.4), az átalakított relatív
_ M (HC1) _ _ _ 0,9125 g.
/ „Megoldás, összesen. _. 4. GT7, JJ4 G.
Kiszámítjuk a kívánt oldat térfogata, amelyet a képlet
oldatot, ahol p - oldat sűrűsége Behelyettesítve ez a képlet a kiszámított értéket a tömegsűrűsége az oldatot, és
NOSTA meghatározott probléma megoldása
^ Oldat = 2535 D 1,179 g / ml = 2,15 ml.
Oldhatóság a szilárd anyagok és folyadékok használva jellemeznek oldhatósági együttható, amely azt mutatja, hogy a maximális anyag tömege lehet feloldunk 100 g oldószer. oldhatóság együttható gyakran nevezik egyszerűen oldódnak. Egy oldat, amelyben egy anyag egy adott hőmérsékleten már nem oldjuk, az úgynevezett telített
Példa Példa 2.8. Oldhatósági együttható g kálium-permanganát 20 ° C-on 6.4 Számítsuk ki a frakciójának tömegét kálium-permanganát telített oldatban ezen a hőmérsékleten
Határozat. Tegyük fel, hogy a oldott anyag tömege a kálium-permanganát, 6,4 g, majd, a meghatározás alapján az együttható oldhatóság, a víz tömege 100 g és a tömeg az oldat - az összeg az oldott anyag és oldószer:
/ "Solution = /" (KMPO 4) + / n (H 2O) = 6,4 g + 100 g = 106,4 g
2.3. Módszerek számszerűsítésére az oldat összetételét
Tömeghányada kálium-permanganát telített oldatban összhangban az (2.4) egyenlő:
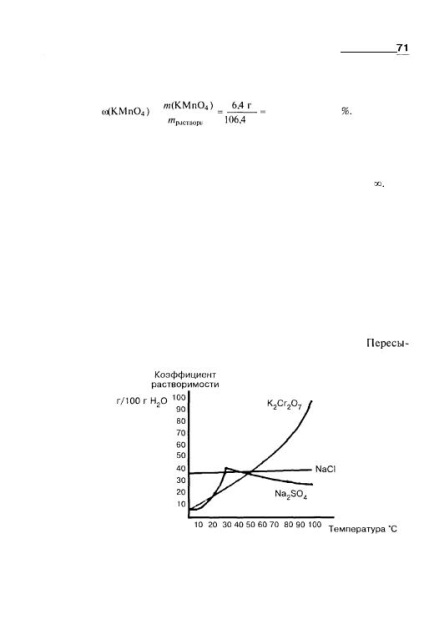
Néhány folyadékok összekeverednek bármilyen arányú, mint például vízben oldható végtelenségig etanol, glicerin, ecetsav sav. Korlátlan oldódást Jele oo. Az oldhatóság növelhető korlátozottan oldható folyadékok, általában a hőmérséklet emelkedésével. oldhatóság mehet korlátlan, amikor egy bizonyos értéket. Például, 16 ° C-on 100 g vízben feloldunk 6,7 g fenolt, de feletti hőmérsékleten 66 ° C, fenol összekeverjük vízzel bármilyen arányban. Oldhatóság szilárd anyagok és általában növeli a hőmérséklet növekedésével. 2.3 ábra képviseli egy különböző jellegű hőmérséklet hatása az oldhatósága bizonyos sóit. Ha az oldatot telített magasabb hőmérsékleten, gondosan lehűtjük, akkor lehetséges egy túltelített oldat, a tömeghányad oldott anyag, amelyben több tömeghányada számítjuk oldhatósági együttható. túltelítettség Ábra. 2.3. A függőség a oldhatósága néhány só a hőmérséklet: a oldhatósága kálium-dikromát növekedésével meredeken növekvő hőmérséklettel; oldhatóságát nátrium-klorid kissé változik, lényegében állandó marad; A nátrium-szulfát oldhatósága először növekvő, majd csökkenő.
Rendelkező anyagok erősen poláros ionos vagy kovalens kötések vizes oldatok kitéve elektrolitos disszociáció kialakulását eredményezi ellentétes töltésű ionok - kationok és anionok. Kationok pozitív töltésű, és mozgassa a külső elektromos mező a katód, anionok - negatív töltésű, vándorolnak az anód. Oldatok, amelyek ionokat képes elektromosságot vezető. Olvad ionos vegyületek is képesek vezeti az áramot. Az oldatok vagy olvadékok tartalmazó ionokat, úgynevezett vezetékek villamos a második fajta (a vezetékek első fajta említett fémek, amelyben a villamos hordozók elektronok). Az elektrolitok anyagok képzésére alkalmas vezetékek a második fajta. Elektrolitok is nevezik magukat oldatok vagy olvadékok tartalmazó ionokat. Gyakorlatilag az összes azok a sók, savak és bázisok. Az elmélet az elektrolitos disszociáció javasolt 1887-ben a svéd kémikus S. Arrhenius.
Anyagok egy gyengén poláros és nem-poláros kovalens kötések, képtelen elektrolitos disszociáció, úgynevezett nem-elektrolitok. Ezek mind egyszerű anyagok, szénhidrogének, néhány más szerves anyagok. Az a képesség, molekuláris szerek elektrolitos disszociáció nem jellemzi egyedi anyagra, és a rendszer - + oldott anyag oldószerben. Például, az etanol, a C 2 H 5 OH vízben - neelektrolit és folyékony ammóniában - elektrolit. Hidrogén-klorid vizes oldatban - elektrolit és a benzolos oldatot - neelektrolit. Mivel a legnagyobb érték az életünkben vizes oldatok, ezért ebben a fejezetben szorítkozunk oldatokra, amelyekben az oldószer víz.
Elektrolitok, viszont vannak osztva erős, közepes és gyenge. Erős elektrolitok disszociálhat teljesen: ez azt jelenti, hogy az anyag az oldatban van, gyakorlatilag csak az ionos formában. Erős elektrolitok közé tartoznak a legtöbb anyag ionos összetétele, azaz. E. sók, valamint néhány anyagok molekuláris szerkezetét, például HC1. Gyenge elektrolitok disszociálnak kis mértékben, és az uralkodó formája létezésük az oldatban molekuláris. Átlagos teljesítmény elektrolitok disszociálnak úgy, hogy a koncentrációja ionok és molekulák azok megoldásait összehasonlítható.
2. fejezet megoldások és diszperziók
Mennyiségileg, a képesség az elektrolit a molekuláris disszociáció ionizáció mértéke által meghatározott (a):
L'Obsch ahol - a teljes száma molekulák oldatban jelenlévő; N Hmm - molekulák száma bomlott ionok.
az ionizáció mértékét százalékban fejezzük ki egységek vagy részvények. A disszociációs mértéke 0,01 vagy 1% azt jelenti, hogy 100-molekulák, az oldott anyag, csak az egyik felosztási ionokra. Amint azt a későbbiekben ismertetjük 9. fejezet, disszociációs mértéke függ az elektrolit koncentráció; növekszik a csökkenő koncentráció. Ezért, összehasonlítani a elektrolitok a mértékét ionizációs csak bizonyos elektrolit koncentrációk. Ha a ionizáció mértéke a elektrolit oldat moláris koncentrációja 0,1 mol / l nagyobb, mint 30%, akkor azt erős, ha kevesebb, mint 3% - gyenge. Elektrolitok, amelyre a ionizáció mértékét ez a koncentráció tartományban közepesnek tekinthető.
Elektrolitikus disszociációs egyenlet írható fel egyenletei hagyományos reakciókban, erős elektrolitok - egyoldalas nyilat, közepes és gyenge - kétirányú, például:
Példa Példa 2.10. A 500 ml vízben feloldunk 3,33 g kristályos alumínium-szulfát kristályosítás 18 vízmolekulák. Számítsuk ki a moláris koncentrációja egyes ionok a kapott oldatot. A kötet változás oldódás közben elhanyagolták.
Határozat. A képlet egység Ennek a kristályos - A1 2 (SO 4) 3 - 18H 2 O. Mi megtalálja a vegyület mennyisége az (2.2):
Az anyagmennyiség az alumínium-szulfát, a disszociációját „ionok képződnek amely megegyezik a kristályos anyag mennyiségének:
«(A1 2 (SO 4) 3) = I (A1 2 (8o 4) 3-18 H 2 O) = 0,005 mol.
Az egyenlet elektrolitos disszociáció alumínium-szulfát, amely szem előtt tartva, hogy ez az anyag, mint a legtöbb sók - erős elektrolit:
A1, (SO 4) -> 2A1 1+ + 3SO ^

2.4. elektrolitos disszociáció
Amint az a fenti egyenletből,
l (A1 3+) = 2n (A1 2 (8o 4),; / i (SO |
Miután ebben az esetben kiindulási anyag mennyisége az alumínium-szulfát kapjunk
l (A1 3+) = 2-0,005 = 0,01 mol; l (5O ^
) = 3-0,005 = 0,015 mol.
Ha használjuk a általános képletű (2,1), ki tudjuk számítani a moláris koncentrációja mind az ionokra oldatban:
Példa Példa 2.11. Bizonyos térfogata ammónia oldat 1,814 mmol ammónia molekulák és ammóniumionok 0,186 mmol. Számítsuk ki a ionizáció mértéke ammónia ebben az oldatban.
Határozat. Az egyenlet a elektrolitos disszociáció ammónia, figyelembe véve, hogy ez egy gyenge elektrolit:
N H 3 + H 2 O * ± №TS + OFT.
Összhangban a fenti egyenlet ammónia anyag alá ionizációs (l ionsh) száma megegyezik az ammónium-ionok anyagok:
W (NH 3) m> H Hj = «(NHJ) = 0,186 mM.
A teljes mennyiségű ammónia anyag oldatban, az összege mennyiségű ammónia anyagok alá ionizáció, és az ammónia egy molekuláris formában:
N (MH 3) tot = L (MH 3) ionsh + «(NH 3) 40 ^ KW = 0,186 + 1,814 mmol mmol mmol = 2.
Általános képlet szerint (2.6), a ionizáció mértéke ammónia ebben az oldatban:
a = nCNHaUHH. = ° - '86 mmol = Q / J93 ^ 9> 3% «(NH3) of.iu 2 mmol

2. fejezet megoldások és diszperziók
2.5. Általános megtekintés
A diszperz rendszerek
Miután előre társkereső a tulajdonságait a megoldás röviden megvitatják a tulajdonságait diszperz rendszerek. Heterogén diszperziók vannak osztva nagydiszperzitású rendszerek (részecskemérete 10
7 m) és durva rendszer (részecskemérete 10
5 m). Az összesített zúzott részecskék a diszperz rendszereket nevezik a diszperz fázist és a közeg, amelyben az aprított szemcsék vannak eloszlatva, - a diszperziós közeg.
Példák a rendszerek durva szuszpenziók és emulziók. A szuszpenziók a szilárd részecskék (diszperz fázis) diszpergálva egy folyékony diszperziós közegben. A diszperz rendszerek, amelyekben a szilárd kalcium-szulfát részecskéket vízben diszpergáljuk, - egy példa a szuszpenzió. Az ilyen szuszpenziót úgy alkalmazzuk, például gipszkarton fal és gyártási művészeti termékek (gipsz), és azért, hogy vet a gyógyászatban. Emulzió - egy durva típusú rendszer, amelyben kis cseppek egy folyadék (diszpergált fázis) diszpergálunk a folyékony diszperziós közegben. A klasszikus példa egy emulzió - tej, amelyben a zsírcseppek diszpergáljuk vizes só-oldatot, és a fehérjék.
Nagydiszperzitású rendszerek, más néven kolloid diszperz rendszerek, vagy szólok, köztes a valódi megoldások és durván diszpergált rendszereket. Ezek, például, mint a valódi oldatok, átmegy egy hagyományos szűrő, míg az ilyen szűrőberendezések durva részecskék megmaradnak. Kolloid diszperz rendszerek, valamint a felfüggesztett rendszer, rétegzett. Kormányzati diszpergált kolloid rendszerek jellemzője opálosság amelyek szubjektíve értékelni, mint egy köztes állapot között az átlátszó oldatot, és a zavaros szuszpenziót. Ha figyelembe vesszük a szol, helyezzük egy kémcsőben, az oldalán, azaz. E. áteső fényben, az a benyomás rendszer átláthatóságát. Ha figyelembe vesszük az azonos szol visszavert fényben, azaz a. E. nézni a csőbe felülről lefelé, az a benyomás zavarosság rendszert. Ha a szol irányítani egy vékony fénysugár, láthatjuk nyomát fényáteresztés a hamu formájában világító kúp (Tyndall kúp) (ábra. 2.4).
Kolloid diszperz rendszerek fontos szerepet játszanak az emberek életében. Szinte minden növényi és állati szövetek organiz-
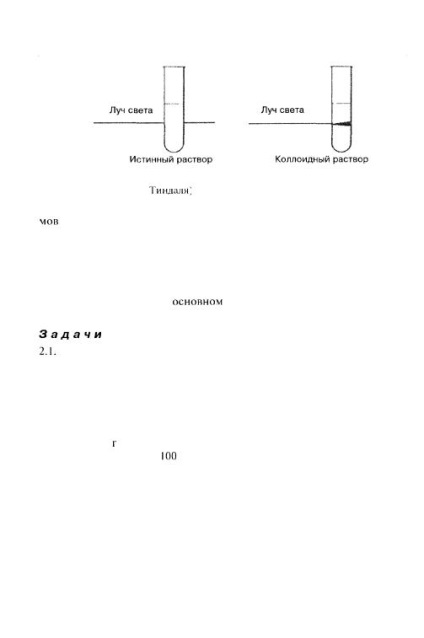
Ábra. 2.4. Amikor a fény áthalad a fénysugár szol látható világító kúp (Tyndall kúp)
mov kolloidálisan diszperz rendszer. Ezek közé tartoznak bizonyos gyógyszerek, számos élelmiszeripari termék, valamint a felhasznált anyagok az iparban és a mindennapi életben.
Diszperz rendszerek, amelyekben a diszperziós közeg egy gáz, úgynevezett aeroszolokat. Füst, köd, szmog - aeroszol mintákra.
Az ingatlan a megoldásokat (lásd a fickó. 9) és diszperz rendszerek (lásd a fickó. 20.) elsősorban részletesen során.
2.1. Etanol 90 g feloldunk 410 g vízben. Számítsuk ki a tömeghányada az alkohol a kapott oldatban.
2.2. Számítsuk ki a tömeg nátrium-hidroxid, foglalt 1,2 kg 7,5% -os oldat.
2.3. Számítsuk ki a víz tömege tartalmazott 170 g 10% -os kálium-klorid-oldat.
2.4. Számítsuk ki a tömege 19% kálium-nitrát-oldat, amely tartalmazott 95 g sót.
2.5. Előállítása 100 g tömegű frakció 24% -os kénsavat adunk 300 g vizet. Számítsuk ki a tömeghányada a sav az új megoldás.
2.6. Előállítása 200 g súlyú tömegű frakció 25% -os kálium-hidroxidot adunk hozzá 50 g ugyanezen lúg. Számítsuk ki a tömeg aránya lúg az új megoldás.
2.7. Egy 500 g tömegű frakció lítium-nitráttal 4% 300 g víz elpárolgott. Számítsuk ki a tömeghányada só az új megoldás.
2.8. A megoldás súlya 250 g tömegű frakció 40% magnézium-klorid 50 g kristályos sót. Számítsuk ki a tömeghányada só az új megoldás.

2. fejezet megoldások és diszperziók
2.9. Mass kénsav 14,7 g vízben feloldunk, és az oldat térfogatát 200 ml-re. Számítsuk ki a moláris koncentrációja sav a kapott oldatot.
2.10. Mi tömegű kálium-dikromát szükséges oldat térfogatát 0,75 liter moláris koncentrációja 0,2 mol / l?
2.11. Az, hogy milyen mértékben az oldatot, amelynek moláris koncentrációja bárium-klorid-0,12 mól / l biztosít 6,24 g sót?
2.12. Ammónium-szulfát tömegű 45 g-ot feloldunk 180 g vízben, így fordult sűrűségű 1.115 g / ml oldat. Számítsuk ki a tömeg százalékos só oldatban.
2.13. Számítsuk milyen súlya sóoldatot tömegtörtje 5% kell venni, hogy készítsen 100 g olyan oldatot azonos só tömegű frakció 2%.
2.14. Számítsuk milyen súlya sóoldatot tömegrésze 10%
kell venni a készítmény 1 kg ugyanilyen oldatban sót egy tömeghányad egyenlő 8%.
2.15. Számítsuk ki a víz tömege amelyet hozzá kell adni, hogy 0,5 kg sóoldatot tömegrésze 20%, hogy oldatot kapjunk az azonos só
tömegű frakció 15%.
2.16. Számítsuk ki a víz tömege amelyekhez hozzá kell adni, hogy egy oldatot a sót egy tömegtörtje 20%, így 0,5 kg olyan oldatot azonos só
tömegű frakció 15%.
2.17. Számítsuk ki a moláris koncentrációja zhsleza-klorid (II) tömegű frakció 10% (op. 1,092 g / ml).
2.18. Számítsuk ki a moláris koncentrációja a réz-szulfát oldat tömegű frakciót egyenlő 0,12 (PL. 1,131 g / ml).
2.19. Számítsuk ki a moláris koncentrációja a nitrát oldat króm (III) tömegű frakció 16% (op. 1.141 g / ml).
2.20. Számítsuk ki a moláris koncentrációja a kobalt-bromid-oldatot (P) egy tömeghányad egyenlő 0,18 (PL. 1,182 g / ml).
2.21. Számítsuk ki a tömegfrakciója salétromsav oldatban moláris koncentrációban, ami azonos 6.273 mol / l (op. 1,200 g / ml).
2.22. Számítsuk ki a tömegfrakciója kénsav oldatban moláris koncentrációja egyenlő 0,1783 mol / l (op. 1.010 g / ml).
2.23. Számítsuk ki a tömeghányada sósav oldatban moláris koncentrációja egyenlő 1,20 mol / l (op. 1,025 g / ml).
2.24. Számítsuk ki a tömeg frakció a foszforsav oldatban moláris koncentrációban, ami azonos 1.510 mol / l (op. 1,075 g / ml).
2.25. Számítsuk ki, hogy mennyi az alumínium-klorid-oldatot tömegű frakció 0,16 (pl. 1.149 g / ml) elkészítéséhez szükséges 500 ml olyan oldathoz moláris koncentrációja 0,1 mol / l.
