A szekvenciát a töltés pályák elektronokkal - elektronok
I. RÉSZ ÁLTALÁNOS KÉMIA
2. az atom szerkezete
2.4. Electron. elektronikus rétegek
A modern elmélet az elektronikus szerkezet az atom épül fontos ága a fizika - kvantummechanika, amely leírja a tulajdonságait mikroszkopikus tárgyakat.
Szerint a fogalmak a kvantummechanika, az elektron, mint mikrorészecskék kettős természete van: tulajdonságait mutassa részecskék és hullámok. Úgy véljük, a pályáját a mozgás, és csak a valószínűsége, hogy a tér az atommag körül. A tér a mag körül, ahol a legvalószínűbb (
90%) az elektron nevezzük orbіtallyu. Minden elektron egy atomot foglal egy bizonyos orbitális és az elektron-felhő formák. Az elektron felhő - gyűjteménye különböző rendelkezései az elektron, amely állandó mozgásban van.
Pályák grafikusan ábrázolják, mint egy sejt, más néven kvantum egységet, és az elektronok kerülnek a orbitális, show nyilak. Mindegyik orbitális lehet az egyik vagy (maximum), két elektron eltérő kvantum tulajdonságokkal - 1 pörgetés (Pauli-elv).
Ez a két elektron, amelynek egymással ellentétes spіni jelölik Stacked ellentétes irányú nyilak Ezek az elektronok nevezzük párosítva. Ha az egyik elektron pályák is, ez az úgynevezett párosítatlan és jelentésük
A legfontosabb jellemzője az elektron (nézve a tulajdonságok kémia) az energia. Az elektronok, amelyek azonos vagy közel arra a szintre, az energia halad orbitálok közel méretű alkotnak energiaszintet (e rétegeket, elektron héj). azok számozva kezdve a nucleus: 1, 2, 3, 4, 5, 6, 7 (néha kijelöl rendre latin betűkkel K, L. M, N. O, P, Q). A maximális energia szintek számszerűen egyenlő az elem száma az időszak, amelyben található.
Egy egész szám n. szintjét jelöli szám, az úgynevezett főkvantumszámú. Ez jellemzi az energia az elektronok, amelyek elfoglalják az energia szintet. A legalacsonyabb energiájú elektronok első energiaszint legközelebb a mag. Mivel, mint az első szint elektronok, elektronok jellemzik a következő szintjeit nagy tartalék energiával. Ennek megfelelően, ez a külső réteg sokkal gyengébb elektronok kötődik a sejtmagba.
A legnagyobb számú elektronok energiaszinten kétszeresével egyenlő a tér a szint száma, azaz:
ahol N (e -) - az elektronok száma,
n - szint száma (jobbról a kernel), vagy a főkvantumszámú.
Így, az első energiaszint lehet befogadására 2 elektront a második - nem több, mint 8, a harmadik - nem több, mint 18, a negyedik - nem több, mint 32.
A maximális feltöltési szint az úgynevezett teljes, és az elektronikus elemek borítékot a kitöltött külső energia szinten - az elektron héj a nemesgáz 2.
Energiaszint áll al-szintet. Mindegyik alréteg is befogadja korlátozott számú elektronok. A szám a sublevels határozza meg az energia szint száma. A Földalatti szintek száma azonos főkvantumszám: az első szint egy alréteget, a második - két, 3-3, 4-4 sublevels és így tovább. Latin betűkkel jelölik sublevels 3.
• s -poduroven első áll egy s orbitális;
• a második p-alréteg három p pályák;
• d -poduroven harmadik áll, öt d pályák;
• A negyedik f - szintalatti tartalmaz hét f - pályák.
Pályák bizonyos távolságokban a sejtmag, egy bizonyos alakú és térbeli orientáció. A legegyszerűbb formában - gömb (golyó alakú). Úgy hívják s -orbіtallyu, és elektronok, amelyek székhelye rajta, - s-elektronok. Egy másik formában egy p-orbitális: egyfajta ömlesztett nyolc vagy súlyzó. Az ilyen orbitális egy atom található tengelyek mentén a térbeli koordináta interperpendicular X. 0 0 0 Y és Z., és ezért azok pixel. Py és p z. Együtt, a három p pályák befogadóképessége legfeljebb hat p elektronok (két mindegyikre). Vannak még bonyolultabb formák pályák:
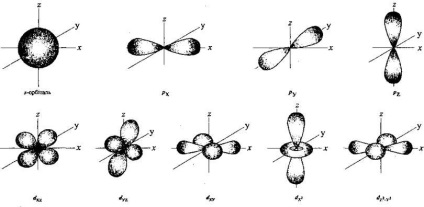
1 spin (angol fordítása - fonás) jellemzi a forgatás az elektron saját tengelye körül; az egyik a kvantum számok (-1/2, +1/2) leírja tulajdonságait az elemi részecskék. A kvantum számok kvantummechanika - kvantum numerikus változók értékei mіkroob'єkta leírja az állapotát.
2. Az az elképzelés, a stabilitás a kitöltött elektronikus réteg kínált kiemelkedő amerikai fizikai kémikus Gilbert Newton Lewis (1875-1946), bár a kifejezés maga oktett (oktett elmélet), soha nem használt.
3 megnevezések társított kezdőbetűiből a szavak, hogy jelenti ábrázolása egy lehetséges formája felhők: s-elektron felhő valószínűleg van egy gömb alakú (fr gömb.), P - gantelepodіbnu (fr poignees.), D - diskopodіbnu (fr disque.). A modern koncepciók nap -oblako nem korong alakú pályák, ezért a következő latin betűk jelölik: f. g. h.
2.4.1. A szekvenciát a töltés pályák elektronokkal
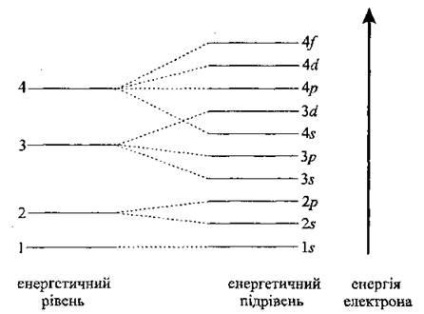
A szekvenciát a töltés elektron pályák által meghatározott több iránymutatás. Egyikük - elvének minimális energia: az elektron egy atom foglal olyan helyzetben, hogy az energia minimális (általában Klєchkovskogo).
A alapállapotú atom jellemzi minimális energia. És ezért az elektronok töltse az orbitális szerint növekvő sorrendben energiát. Először is, az első energiaszint van töltve. A következő (második) van töltve csak az első energiaszint teljesen fel van töltve. A harmadik után egy második tölteni. Az elektronok, amely kerülnek a külső energia szinten, az úgynevezett külső, vagy vegyérték. Ezek határozzák meg a kémiai tulajdonságait elemek.
Egy-egy szinten, például a második, az első töltési -poduroven s, akkor p -poduroven.
Vegye figyelembe, hogy d3 -podurovnya energia meghaladja az energia -podurovnya 4 s, ezért először töltjük 4 s. 3, és csak ezután d -poduroven stb eloszlása az energia szintek és sublevels a bagatoelektronnomu atom (sorrendben növekvő energia) .. 1 s 2 s 3 s 2P, 3P 4 4p s d 3 s 4 5 d 5 o 6 s.
A eloszlása elektronok az atom az energiaszintek és sublevels van ábrázolva képletek e. Kidolgozásakor az elektronikus képlet a következő szabályokat:
1. A töltés folyamán az egyik alréteg, elektronokat úgy vannak elrendezve, hogy a teljes centrifugálás volt maximális (ez megfelel a stabil állapotát az atom) (általában Gunda).
2. Spіni párosítatlan elektronok különböző pályák párhuzamosnak kell lenniük. Például, ha a p értéke 3 -podurovne elektronok, vannak elhelyezve három különböző p pályák. Py és p z.
Az elektronok töltés szintek és sublevels szemléltetik elektronikus szerkezeti képlet és azok változatai. Például, az első időszakban venni csak két elem - a hidrogén (H) és a hélium (He). Hidrogénnyomáson egyetlen (páratlan) 1 s elektronok a talajszinten, amely a következőképpen írható fel:
Mivel az első szinten nem lehet több, mint két elektron, a héliumatomot ez már megtörtént - nem 2 1 2 s az héliumatomot az első energiaszint két különálló s elektronok ellentétes forog.
A elemei a második időszak tele van egy második energiaszintre (n = 2). A lítium és a berillium újra kezd megtelni s -poduroven: 3 Li 1 s 2 2 s 1 (szintén rögzített rövidített elektronikus képlet 3 Li [Ő] s 1, 2 vagy 3, Li 2 s 1, hogy a jövőben, és a jövőben sem lesz. ) 2. 4 Ve [Ő] 2 s s 2. túl elektronok, de az energia nagyobb, mint 1 s. Ők alkotják a nagy méretű, orbitális távolabb a sejtmagban.
A következő hat elem Bora és befejező neon töltött -poduroven p. Elektronikus képletek ezen elemek a következők: 5 [Ő] 2s 2 2p 1; 6 másodperc [Ő] 2s 2 2 2 p; 7 N [Ő] 2s 2 2p 3; 8 O [Ő] 2s 2 2 p 4; 9 F [Ő] 2s 2 2p 5; 10 Ne [nem] 2s 2 2p 6.
A második az energia szintet, mint már említettük, lehet, nem több, mint 8 elektronokat. A elemei a 3. időszak kezdődik alkotnak egy harmadik energiaszintre (n = 3), amely már tartalmaz bizonyos maximálisan 18 elektronok; nevezik őket s-elemek (11 Na [Ne] 3 s 1; 12 mg [Ne] 3 s 2), és a p-elemek (13 Al [Ne] 3 s 2 p 3 1; 14 Si [Ne] 3 2 s 3 p 2; 15 P [Ne] 3 s 2 3 p 3; 16 s [Ne] 3 s 2 3 p 4; 17 Cl [Ne] 3 s 2 3 p 5; 18 Ar [Ne] 3 s 2 3 p 6 ).
1 A több párosítatlan elektronok az atom jelzi a lehetséges értékek vegyértéke elem. Ezért, hidrogén csak egy vegyértékével - 1.
2 Az expressziós [nem] e képlet tartalmazza az utolsó megelőző nemesgáz atomok, ebben az esetben - Hélium.