energia molekula - studopediya
A molekulák állnak azonos vagy különböző atommal, összekapcsolt egyetlen kötőerők, amelyek úgynevezett kémiai kötésekkel. A gazdaság erői tartalmaznak a molekulában a kölcsönhatás idézi elő a külső elektronok.
Kétféle a kommunikáció. Egyikük végezzük azok a molekulák, amelyekben egy része külső elektronok körül mozog a két mag (korlátozzuk magunkat csak kétatomos molekulák). Egy ilyen kötés nevezzük kovalens vagy kovalens kötés. Kapcsolásával ilyen molekulák közé tartoznak a molekulák azonos magok (H2. N2. O2) és a molekulák különböző magok (például, CN).
A második típusú kapcsolás következik be abban az esetben, ahol az elektronok a molekulában lehet két csoportra oszthatók, amelyek mindegyike jelenleg található az egyik a magok. Az elektronok eloszlása olyan, hogy az egyik sejtmag körüli felesleg elektronok, hanem a másik - a hátránya. Így a molekula áll két ion ellentétes előjelű, vonzzák egymást. Ez a fajta kommunikáció hívják heteropoláris vagy ionos. Egy példa az ionos kötést molekuls szolgálhat NaCl, KBr, sósav és így tovább. D.
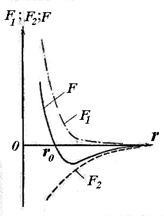
Függetlenül attól, hogy a természet a erők, amelyek miatt egy stabil rendszer két atom lehet, hogy néhány általános észrevételeket jellegétől ezeket az erőket. Az atomok található egy jelentős távolságra egymástól, nem lép kölcsönhatásba más íveket. Csökkentésével a távolság r közötti atommagok növeli a kölcsönös vonzóerő között ható az atomok (lásd. Ábra. 11,5, F2). Azonban ezek az erők nem az egyetlenek. Abban a kis távolságok az atomok közötti fejtik ki hatásukat erők kölcsönös taszítása F1. nem teszik lehetővé az elektronok egy atom túl mélyen behatolnak a elektronhéjak a többi atom. taszító erő egy rövid hatótávolságú, mint a gravitációs erő. Mivel a egyidejű hatása szemben irányuló erőket - vonzás és taszítás - a parttól r0 az atomok között a két egymást kiegyenlítik, és a geometriai összeg (az eredő erő F) nulla.
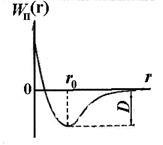
Ez a távolság megfelel a legkisebb kölcsönös potenciális energia Wp (r) az atomok egy kétatomos molekula. Ábra. 11.6 ábra a görbéjét potenciális energia Wp r (R) közötti kölcsönhatás két atom a molekulában. Egyensúlyi atomközi távolsági r0 a molekulában nevű kötéshossz. A mennyiség D (a görbe ábra. 11.6) határozza meg, az energia a molekula kötések. Ez számszerűen egyenlő a munka el kell végeznie ahhoz, hogy megtörje a kötések az atomok a molekulában.
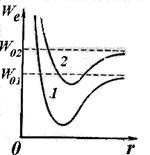
Alapvetően változtatni energiatároló molekulákat bekövetkezik, mint az atom, mint a változások eredményeként az elektronikus konfiguráció, amely egy kerületi része a molekula. Ha megváltoztatja az elektronikus konfiguráció (amikor gerjesztett molekula) eltolja az elektron energia görbéje közötti távolság a magok (lásd. Az 1 és 2 görbe az ábrán. 11.7). Egy adott elektronszerkezet atomok molekulák alávetni oszcilláló mozgást egymáshoz képest, és forgathatóan egy közös tömegközéppont. A teljes energiáját a nyugalmi állapot a molekula is képviselteti magát:
ahol Mi - energia miatt az elektron konfiguráció, Wv - energia rezgőmozgás, Wr - az energia a forgó mozgás.
Az egyenletek a kvantummechanika, ki lehet mutatni, hogy nem csak akkor, ha a változó az elektronikus konfiguráció, de eltérő energiával vibrációs és rotációs mozgást, az energia az említett típusú mozgás van diszkrét értékek és a következőképpen fejezhető ki:
v = 0, 1, 2, 3, ...; # 969; v - ciklusos rezgési frekvencia; J - a forgási kvantum szám, amely a következő értékeket: J = 0, 1, 2, 3, ...; I - tehetetlenségi nyomatéka a molekula viszonyított átmenő tengely a tömegközéppont.
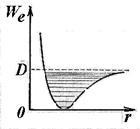
Egyenlet (11.5) határozza meg, az energia egy harmonikus oszcillátor. Mivel az energia-ingadozások (növekedés a kvantum száma v) anharmonicity megfigyelhető, ami a konvergencia a szintek rezgőmozgás, amelynek határát disszociációs energia a molekula (ábra. 11,8).
Így szerint (11,5) és (11.6) polnayaenergiya molekula:
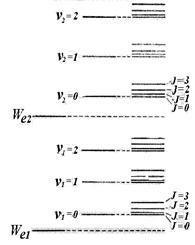
A tapasztalat és elmélet azt mutatják, hogy a távolság a forgási szintek # 8710; Wr lényegesen kisebb, mint a távolság a rezgési szintek # 8710; Wv. ami viszont sokkal kisebb, mint a távolság az elektron szintet # 8710; Mi. Így, az energia szintű rendszert egy molekula néz bemutatott ris.11.9 (csak két elektronikus szinten). Egy sor szintek tartalmazza a jobb oldali oszlopban a szám. Az első két oszlopban csak magyarázza a szintek előfordulásáról.
Molekuláris spektrumok meglehetősen eltérnek a nukleáris energiát. Atomic spektruma áll az egyes vonalak,
molekuláris spektrumok állnak csíkok, egy éles szélek és homályos másik. A tanuló E spektrumok segítségével eszközök nagy felbontóképessége határozza meg a legfontosabb fizikai jellemzői a molekulák: a kötés hossza, kötés energia, a tehetetlenségi nyomaték.