A képződésének mechanizmusát folyadékok - studopediya
Solutions foglalnak közötti közbenső helyzetben a mechanikai keverék egyes anyagok és kémiai vegyületek, amelyek specifikus tulajdonságait mindkét rendszer egyidejűleg jelentősen eltér mindegyik.
Tehát összehasonlítva keverékei megoldások homogénebb és annak bármely részeit ugyanazokkal a fizikai tulajdonságai és kémiai összetétele, valamint az egyes vegyületek.
Ugyanakkor, sok Az anyagok oldatban, mint a mechanikai keverékek változatlan maradjon része inherens tulajdonságaitól őket tiszta formában. Ellentétben a megoldások az egyes vegyületek egy változó összetételű és jellege a különböző közötti kapcsolat a szerkezeti egységek. Ha vegyi anyagok jellemző kovalens és ionos kötések, a megoldások közötti komponensek jelen vannak gyengébb dipólus-dipólus, ion-dipólus vagy van der Waals kölcsönhatások, és bizonyos esetekben - hidrogénkötések, donor-akceptor kölcsönhatások.
Így, az oldódási folyamat nem tekinthető egyszerű mechanikai eloszlása egy anyag egy másik.
Dmitri Ivanovics Mengyelejev
(1834-1907).
Valóban nagy tudós. Nem úgy tűnik, hogy senki sem a kémia, amit nem járultak hozzá. A legismertebb működésének, kivéve a periodikus törvény, ez a felfedezés „abszolút forráspont hőmérséklet” (a kritikus pont), a fejlesztés a fizikai és kémiai (hidrát) oldatban elmélet, a készítmény egy általánosított gáztörvény. A másik fő üzleti életének Mengyelejev tartják a tankönyv „Fundamentals of Chemistry”.
Az oldódás végbemegy fiziko-kémiai kölcsönhatások az oldott anyag és az oldószer-molekulák, mint amelynek eredményeként megtöri az eredeti szerkezetét és az új szerkezet alakul, jellemző megoldás. Megkülönböztetünk fizikai és kémiai oldási lépésben anyagok, amelyek egyszerre.
Lépésben történik a fizikai őrlési eljárás (diszperzió), az oldott anyag elválasztására molekula vagy ion, és azok egyenletes eloszlását az egész oldat térfogata. Ez végzi az intézkedés az oldószer molekulák az anyag és a diffúziós áramlás.
Ebben a szakaszban az energia mindig elfogy, mert meg kell törni a kötést a kristályrácsban a szilárd vagy intermolekuláris kötések oldódás alatt folyadékot.
Azt állítjuk, a mechanizmus e folyamat által példája oldás H2 O KCl-sót, melynek ionos kristályrács (ábra. 18).
oldószert dipólusok orientált megfelelő képest a kristályrács ionok a felszínén, és ennek eredményeként a termikus mozgás és oszcilláló mozgása ionok egymás után húzza őket a rácspontok és oldatba vittük.
Minél erősebb a kötés a kristályrács, annál több energiát kell fordítható annak megsemmisítését. Intermolekuláris kötések a folyadékokban általában gyengébb, mint a szilárd anyagok, így az energia feloldásával zatrachiva-
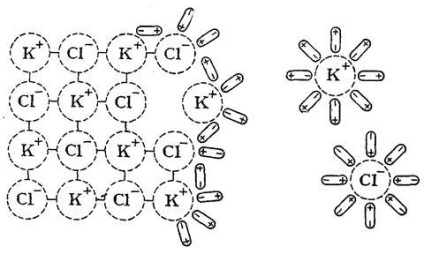
Ábra. 18. A mechanizmus oldódási Az ionos vegyület (KCl) vízben
etsya sokkal kevesebb. A gáz molekulák gyakorlatilag nem csatlakozik, így a fizikai történő feloldásának lépése nem fogyaszt energiát.
Lépésben kémiai oldódási reakció megy végbe oldott részecskék (molekulák vagy ionok) az oldószer-molekulák és a kémiai vegyületek képződnek: hidrátok (ha kiáll H2 O oldószer) vagy ezek szolvátjai (ahol az oldószer hat, mint bármely más folyadék).
Jellegétől függően az oldott anyag szolvátjait (hidrátjait) is elő eredményeként fizikai kölcsönhatások: ion-dipólus (amikor oldott ionos anyagok struktúra) és dipólus-dipólus (amikor oldott anyagok, amelynek a molekulaszerkezete), és a kémiai.
Kémiai kölcsönhatások fordulnak elő kialakulásán keresztül donor-akceptor kötés. A ionok akceptorok oldott anyag és az oldószer molekulák (H2 O, NH3) - donorok elektron pár. Ezáltal hidrátok különbözőképpen hívják aquacomplexes. [Cu (H2 O) 6] 2+. [Al (H2O) 6] 3+. Kialakulásuk oldatban gyakran kíséri a színváltozást. Mivel a felbomlása vízmentes réz (II) -szulfátok fehér vezet intenzív kék elszíneződés. Hidratált héj poláris szerves molekulák jelennek meg, mert a hidrogén kötések kialakulását közötti funkcionális csoportok és a vízmolekulák.
Mivel a hidrátok képződésének (szolvátok) történő feloldásával sok anyag fordul szerződő - térfogatú kompressziós rendszerek, mert a öntömítő (különösen abban az esetben, tömény oldatok). A kötet a kapott oldatot kevesebb lesz, mint az összege térfogatú oldószer és az oldott anyag (kivéve, ha az utóbbi egy gáz).
Oktatási hidratáció (mennyiségű) membránok mindig kíséri az energia felszabadítását. Hidratálásra ionok felszabaduló energia mennyiségét és számát tartott vízmolekulák attól függ, hogy mekkora a töltés és sugár.
Minél nagyobb az ion töltése, és kisebb, mint a sugara, annál több energia szabadul fel, és a stabilabb hidrát burok képződik (ábra. 19).
Ábra. 19. függése a méret a hidratációs héját ionok a értéke a sugár
Ha az anyag oldatban formájában molekulák, az összeg a felszabaduló energia a hidratáció során arányos annak molekuláris polaritás.
A termikus a részecskék mozgását az oldott anyag az oldatban mozog együtt a hidrátja (a szolvát) héjak, amelyek ezeket együtt.
A legtöbb esetben a kapott hidratált (szolvatált) membránok törékenyek és könnyen megsemmisült még alacsony hő egy tekercs vagy anyagok az oldatból. De néha hidratált vegyületek annyira stabilak, hogy esik ki az oldatból a kristályos formában, amelyeket különbözőképpen hívják kristály hidrátok. és tartalmaznak H2O - kristályosítással.
A kémiai képletek kristályos molekulák H2 O vannak írva a ponton át (lapon. 5). Ezekből képletek mutatják, hogy a molekula H2O molekulánként térhatású anyag.
5. táblázat Képletek és triviális nevek kristályos
Hevitésre (néha elég erős) kristály hidrátok elpusztulnak és kristályosítással H2 O bepároljuk.
Fizikai és kémiai oldódási lépésben egyidejűleg megy végbe. Összefoglalás termikus hatás feloldásával az anyag által meghatározott kapcsolat a két szakaszban.
Ha lépésben fizikai energia töltött több, mint a hozzárendelt kémiai szakaszban, akkor a felbomlása ilyen anyag az oldat hőmérséklete csökken, és az energia általában fordított. Ez akkor fordul elő, például úgy, hogy feloldjuk NaCl, NH4 NO3.
Ha lépésben fizikai energia fogy kisebb, mint hozzárendelt kémiai szakaszban, ezek az anyagok, amikor feloldódott, az oldat hőmérsékletét, éppen ellenkezőleg, növekedni fog, és az energia, általában osztják. Ez különösen akkor figyelhető meg, amikor vízben oldjuk, nátrium-hidroxid, kálium-hidroxid, a H2 SO4.
Ha a fizikai szakaszban töltött körülbelül azonos energia juttatott a kémiai, a hőmérséklet az oldat oldódás alatt az ilyen anyagok, gyakorlatilag nincs változás.
Amikor az oldott gázokat mindig felszabaduló hő miatt A fizikai színpadi energia nem fogy.
Termikus oldódása legtöbb anyag csekélyek, azonban észrevehető fűtés vagy hűtési megoldások, általában nem figyelhető meg. Azonban, bizonyos esetekben, például úgy, hogy feloldjuk a H2 O az alkálifém-hidroxidok vagy H2 SO4. van egy ilyen erős felmelegedés a megoldás, hogy lehetne még kezdeni forraljuk. Ezért, a vizes oldatokat készíthetünk, savak és lúgok igényel speciális ellátást. Különösen, a készítmény hígított H 2SO 4-oldatot kis adagokban kell túlfeszültség tömény savat H2 O, és nem fordítva.
Oldódása után NaCl vagy NH4 NO3 oldat hőmérséklete eshet negatív.
A keletkező hő vagy abszorbeált feloldva 1 mol nevű anyag ho-oldatot (Qrastv.).
Oldhatóság szerek.
Befolyásoló tényezők oldhatósága
Egyes anyagok jobban oldódnak egy adott oldószerben, mint mások. Úgy tartják, hogy egyáltalán nem oldódó anyagok. Minden anyag képes oldódás, sőt, bizonyos esetekben nagyon kis mennyiségben (például higany vízben, benzolban, vízben).
Sajnos, a mai napig nincs elmélete, amellyel megjósolni és kiszámítani oldhatóságot ezek megfelelő oldószerben. Ez annak köszönhető, hogy a összetettsége és sokfélesége közötti kölcsönhatások összetevői a megoldást, és a hiánya egy általános elmélet oldatok (különösen a koncentrált). Ebben az összefüggésben, a szükséges adatokat a oldhatóságát anyagok kapunk, általában empirikusan.
Mennyiségileg a képessége egy anyag kioldódási gyakran jellemzi oldhatóság vagy oldhatósági hányados (S).
Oldhatóság (S) számát mutatja gramm anyagot feloldhatjuk, amennyire csak lehetséges az adott körülmények között (hőmérséklet, nyomás) 100 g oldószerben, hogy egy telített oldat.
Ha szükséges, az oldhatóság hányados meghatározása a többi mennyiségű oldószerrel (például 1000 g-, 100 cm 3 1000 cm-3, stb).
Oldhatóság összes anyagot jellegüktől függően vannak osztva 3 csoportban: 1) könnyen oldódnak; 2) mérsékelten oldódik; 3) rosszul oldódó vagy oldhatatlan.
oldhatósági együttható az anyagok az első csoport nagyobb, mint 1 g (100 g oldószer) a második anyagcsoport tartományban van 0.01 - 1,0 g a harmadik csoport anyagok S <0,01 г.
Oldódási anyagok számos tényező befolyásolja, ezek közül a legfontosabbak a természetét az oldott anyag és az oldószer, hőmérséklet, nyomás, a más anyagok is jelen az oldatban (például elektrolitok).