Immunpa az a következtetés - alapján immunológia
Page 15 92
Kétségtelen, hogy az immunrendszer „jó dolog”, de, mint a zsoldos hadsereg, akkor viszont szemben a tulajdonos.
Tehát egy szokatlanul erős immunválaszt, vagy tartós hatása az idegen antigének vezethet szöveti károsodás és a túlérzékenységi reakciók. Példák: allergiás pollen; Blood patológia használatával kapcsolatos néhány gyógyszer; glomerulonephritis által okozott immunkomplexek képződése; krónikus granulomatosis, a tuberkulózis, vagy schistosomiasis.
Más esetekben, a csökkent tolerancia normális, a szervezet saját antigéneket, ami a különböző autoimmun betegségek, mint például pajzsmirigy-túlműködés, myasthenia, sok reumás betegségek.
Egy másik példa a immunpatológiás reakciók - graft kilökődés, ha MHC-antigének a donor okoz erős reakciót a recipiensben. Végül meg kell érinteni az állam az immunhiányos, amely akkor következik be, nem ritkán, és abban nyilvánul meg, nem megfelelő működése az immunrendszert. Úgy tűnik, hogy az olvasó már nyilvánvaló, hogy a fő probléma az immunhiányos kapcsolódó perzisztens fertőzés, természetéből adódóan attól függ, milyen elem az immunrendszer nem működik egy adott esetben.
következtetés
Van egy széles körű mechanizmusok veleszületett immunitás, amely a hatékonyság ismételt érintkezés az antigén nem növelhető. Mikroorganizmusok nehéz behatolni az emberi test egy bőrön védőhatást, nyálka, a csillók kioldódó baktericid hatását folyadékok (például, szakadás), a magas savtartalma gyomorsav és mikrobiális antagonizmus. Ha a baktériumok még mindig leküzdeni mindazon akadályok, azok elpusztult oldható faktorok, mint a lizozim, vagy fagocitózis majd intracelluláris emésztést.
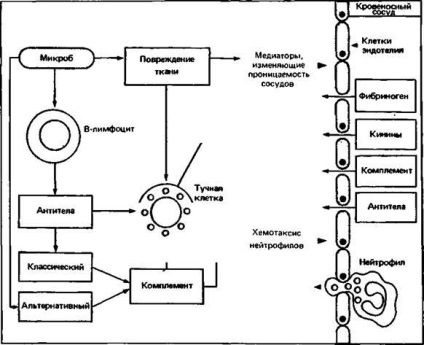
Ábra. 2.17. Válaszul a szöveti károsodás mikrobák (például, bakteriális toxinok) fejleszt egy akut gyulladásos reakciót a komplement aktiválása az alternatív útvonal (1) vagy (2) segítségével az antitest-ravaszt a klasszikus komplement kaszkád aktiválását vagy a hízósejtek degranulációját (erre a célra vannak speciális antitestek) .
A fő fagocita sejtek polimorfonukleáris neutrofilek és a makrofágok. A mikrobák kötődnek a felületi aktivált abszorpciós folyamat, és a sejteken belül, ahol egyesült a citoplazmatikus szemcsék. Akkor érvényben lévő és számos kislorodozavisimye kislorodonezavisimye baktériumölő mechanizmusait.
A komplement rendszer áll számos összetevő; annak az aktiválás egy enzimatikus kaszkád reakció és vezet az abszorpciós mikroorganizmusok által fagociták. komplement komponens képviseli a legmagasabb szérumkoncentráció, azaz a C3 konvertáz szakadások, amely képződik a C3b (bomlásterméke C3) és B-faktor Bound C3b, hogy a felület a mikroorganizmus szerez ellenállás a pusztító hatás tényezők H és I. Az ezt követő aktiválás a C5 alkatrész vezetékek a kialakulása egy kis peptid C5a; a fennmaradó fragmens molekuly - C5b felületéhez kötődik a mikroorganizmus és részvételével komponensek C6-C9 membrán támadó komplex formák, fokozó membrán permeabilitás ami oda vezethet, hogy ozmotikus lízisét a célsejtben. C5a-hatékony kemotaktikus faktora a polimorf magvú leukociták; Ezen túlmenően, ez növeli a permeabilitás kapillárisok. C3a és C5a hízósejteken, amely lehetővé teszi a mediátorok, mint például a hisztamin és a leukotrién B4, amelyek befolyásolják a kapilláris permeabilitás és a neutrofil kemotaxist, valamint aktiválja az utóbbi. A neutrofilek kötődnek mikrobák, C3b vonva egy felületi S3b- receptorokhoz. A polimorfonukleáris leukociták, és növelik az érrendszer permeabilitását indukálják hatásos mikrobaellenes akut gyulladásos reakció (ábra. 2.17).
Más mechanizmusok a humorális védettség a művelet alapján az akut fázis fehérje (például a C-reaktív protein).
Vírusos fertőzések alkalmazásával lehet kezelni interferonok, amelyek gátolják a vírusreplikációt. Nagy szemcsés limfocitákat aktivitásának normális gyilkosok elpusztítják a vírussal fertőzött sejteket.
Sok a nagyobb élősködők nem tudtak rendezni a test miatt a potenciális fogadó extracelluláris rombolás, amely végzi az eozinofil kapcsolódó C3b.
antitest molekula vált, mint egy adapter specifikus kötődését azokkal a mikroorganizmusok, amelyek nem váltanak az alternatív komplement kaszkád aktiválását vagy megelőzésére aktiválását fagocita sejtek.
Az antitest komplexet képez a antigénnel keresztül az antigén specifikus kötőhelyet. Konstans régiók az antitest molekulák aktiválják a komplementet a klasszikus útvonalon (bondage C1
és formáció S4b2b konvertáz hasítás C3), és csatlakozik a ellenanyag-receptorokat felszínén fagociták. Ez a kiegészítő vezető utat az akut gyulladásos válasz fokozott antitest érzékenyítő hízósejtek (ábra. 2.17).
Az antitesteket a plazmasejtek által előállított, amelyek a B prekurzor sejtek, amelyek mindegyike be van programozva a szintézisét antitestek egy adott specificitást. Ezek az antitestek található a sejtek felszínén, és elvégzik antigén receptor funkcióját. antigén kötődést egy specifikus receptorhoz aktiválja a sejtek szaporodását és okoz bizonyos klónok, és végső soron a kialakulását antitest-képző sejtek és a memória sejtek. Más szavakkal, az antigént önmagában gondoskodik a kiválasztási egy klónt, amely antitesteket termel irányított hozzá. Számának növelése memória sejtek alapozás után gyorsabb hatásos szekunder válasz képest az elsődleges. Ez a jelenség az alapja vakcinálás alkalmazásával járó ártalmatlan formában a fertőző ágens a primer befecskendezésre.
Más a limfocita populációk, a T-limfociták, szabályozza a sejten belüli fertőzések. Mint a B-sejtek, az egyes T-sejt-specifikus receptor (és bár szerkezetileg különbözik az ellenanyag-molekula), amely felismer egy antigént. Komplex képződése a T-sejt antigén receptor és okoz klonális expanzióját, képződéséhez vezető effektor sejtek és a memória sejtek, amelyek működését az alapja a konkrét szerzett immunitás. T-limfocita fog felismerni egy antigént a sejt felületén együtt MHC-molekulákkal.
A segítő T-sejtek, amelyek felismerik az antigént MHC molekulákkal komplexben lévő II osztályú termékek a makrofágok felszínén, szekretálnak # 947; interferon, mely aktiválja a makrofágokat, és hozzájárul a tényleges megszüntetését intracelluláris paraziták. A citotoxikus T-limfociták felismerik az antigént és glikoproteinek MHC I osztályba tartozó felületén a vírussal fertőzött sejtek és elpusztítani ezeket a sejteket, mielőtt a vírus replikáció. Azt is kiválasztják # 947; interferon, amely a környező sejtek rezisztensek a fertőzés a vírus (ábra 2.18.).
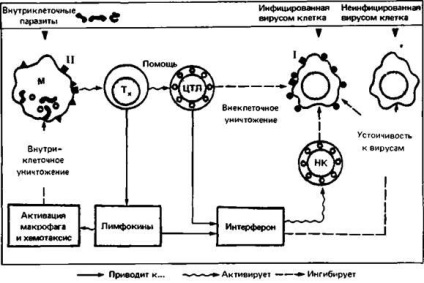
Ábra. 2.18. T-limfociták együtt a veleszületett immunrendszer mechanizmusok küzd sejten belüli fertőzés. A molekulák a fő hisztokompatibilitási komplex osztályok I és II (fekete négyzetek) fontos szerepet játszanak a felismerve a felületi antigén a T-limfociták. T helper (Th) részt vesznek a kialakulása
citotoxikus T-limfociták (CTL) a megfelelő prekurzorok. Baktericid mechanizmusai makrofágok (MF) által aktivált limfokinek. Interferon repiikációját gátolja a vírusok és stimulálja a normális ölősejtek (NK), amelyek együtt a CTL-ek elpusztítsák a vírussal fertőzött sejteket.
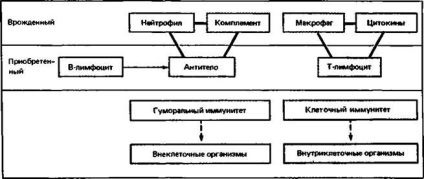
Ábra. 2.19. Két hármas egyesíti a veleszületett és szerzett immunitás.
Bár a hatékonysága a veleszületett immunrendszer mechanizmusok nem növekedett ismételt érintkezés az antigén (ellentétben a mechanizmusokat a szerzett immunitás), értékük igen nagy, mivel szorosan kapcsolódik a rendszer adaptív immunitás a két különböző „hármas”. Ezek hármas alkotják szinte az egész lényege Immunology. Antitest, komplement és polimorfonukleáris fehérvérsejtek ellen nyújtanak védelmet a legtöbb idegen ügynökök extracelluláris és a T-limfociták, szolubilis citokinek a makrofágok és a sejten belüli (ábra. 2.19).
Különböző immunpatológiás reakciók (túlérzékenységi reakció exogén antigének, elvesztése tolerancia normális szervezet saját antigének vezető autoimmun betegségek és transzplantátum kilökődés külföldi) vezethet szöveti károsodás. Immunhiányos bizonyos módon csökkenti a fertőzésekkel szembeni ellenállást.