Homonukleáris molekulák - Kémiai Referencia 21
Homonukleáris kétatomos molekulák [c.49]
Molekulák Oj, NJ és I2, amelyek állnak atomok csak egyféle nevezzük Homonukleáris. Ezzel ellentétben, az ilyen molekulák. így például HC1, CO vagy Hl, úgynevezett heteronukleáris. Hagyjuk keringeni a fent leírt egyszerű módon történő kezelésének a molekulák H, és a H j, alapján az elmélet molekulapályák. a homonukleáris kétatomos molekulák elemeit a második időszakban. Néhány ilyen molekulák. például Nj, OJ és Fj, amelyek normális körülmények között stabil. Mások, mint például a C vagy LIJ, észlelt csak magas hőmérsékleten. voobshe míg mások nem léteznek. Hogyan magyarázza ezeket a tényeket az elmélet molekulapályák [c.520]
Amikor kölcsönható atomok képződött Homonukleáris molekulák (atomok reakciójával egy elemet) vagy heteronukleáris (a kölcsönhatás az atomok különböző elemek). [C.17]
Kitöltése pályák elektronokkal végezzük ugyanúgy, mint abban az esetben, Homonukleáris molekulák. TE molekula izoelektronos C2 különbség abban rejlik elsősorban közöttük olyan módon, hogy a szintek és a [c.538]
Könnyen belátható, hogy ezek a kombinációk lineárisan függetlenek. Tekintsük a kombináció XI és 2. ábrából látható. 4.3, a kapott függvény néz ki, mint egy módosított p-AO egy nagy és egy kis lapátok X1 és / 2 nagyobb pengék mentén vannak a 2 tengelyt ellenkező irányban. Feltesszük Homonukleáris molekula tervbe van véve, hogy a Hückel mindkét 2s AOS van egyforma Coulomb invariáns [c.172]
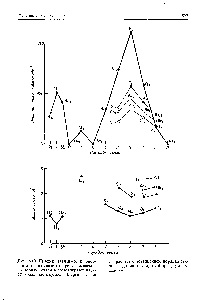
Elektronikus szerkezet Homonukleáris kétatomos molekulák határozza meg mentális folyamatot kitöltésével vegyérték elektronok a molekulapályák. Egy és befejezve a. annak érdekében, hogy a növekvő energia. Így lehet megállapítani, például, hogy az N2 molekula elektronszerkezet CC (a) (egy a-kötést), és a molekula N2 konfigurációja QA (a,) (V) (Aq. Y) (a,) három hatékony csatlakozások (egy a-kötést és két p-hivatkozások). Az effektív száma kötőelektronok osztva 2 ad a hagyományos kommunikációs eljárások. Például, a sorrendben a N2 molekulák csatlakozás 1, és az N3 a kötés érdekében 3. A növekvő sorrendben a kommunikáció egy előre meghatározott kommunikációs rendszerben Homonukleáris kétatomos csökken a hosszúsága és a kötési energiát nőtt. [C.544]
A lehetséges rotációs állapota attól függ, hogy a molekula Homonukleáris N. O) vagy heteronukleáris (HC1). Ezért úgy véljük, két esetben külön-külön. [C.246]
Az egyetlen lehetséges ingadozását a kétatomos molekula egy atomi mozgást a tengely mentén összekötő mindkét mag. Ha Homonukleáris molekula (O2, I2, és így tovább. D.) Nyilvánvaló, hogy a központok pozitív és negatív töltések minden fázisában az oszcilláció azonos és dipólmomentum mindig nulla. A fluktuációk az ilyen molekulák nem kíséri a infravörös sugárzás elnyelése, és az úgynevezett inaktív az infravörös spektrumban. Másrészt, ha az atomok egy molekulában különböző (HC1, CO, és a t. D.), Az elektronikus eloszlása oszcilláció változik vegyértékkötés. Ebben az esetben a központok pozitív és negatív töltések nem mindig esik egybe, így a dipólmomentum változásokat. Az ilyen rezgések nevezzük aktív. Ezek kölcsönhatásba léphet elektromágneses sugárzás, verejték [C.13]
Ábra. 3. széteső (a) és az összekötő (b) a hullám funkciók egy Homonukleáris kétatomos molekula

Vizsgálata az elektronikus szerkezet általános formája a heteronukleáris kétatomos molekulák AB végezzük mint ahogy ez történt az Homonukleáris molekulák. Mindkét esetben hasonló orbitális energia diagramok. azzal az egyetlen különbséggel, hogy az orbitális szintek elektronegatívabb atommal található mélyebb, mint a kevésbé elektronegatív atom (ábra. 12-13). Ezért, ragasztás molekulapályák tartalmaznak túlsúlyban hozzájárulást több elektronegatív atommal. és antibonding pályák-predomináns [c.537]
Miért orbitális képek heteronukleáris kétatomos molekula látható. 12-14 különböznek a megfelelő kép Homonukleáris kétatomos molekulák ábrán. 12-7 [c.546]
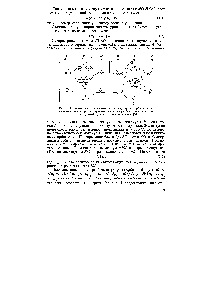
Úgynevezett kétatomos molekulák Homonukleáris és heteronukleáris mi [c.545]
A legtöbb esetben, a fő távú kétatomos molekulák - van, de a homonukleáris molekulák Vannak kivételek, mint például a [c.198]
Entrópia növekszik, mert a molekulák a termék nehezebb (ezek heteronukleáris), mint a molekulák a reagensek (homonukleáris). Ez a növekedés azonban az entrópia kicsi. [C.532]
Az alábbiakban példaként figyelembe vesszük a tartozó molekulák egy pont-csoport szimmetria Ezek közé tartozik az összes kétértékű Homonukleáris és heteronukleáris többértékű lineáris szerkezet egy központja inverzió HC CH, C = 0, és m = 0. A D. [C.192]
1. ábra: A relatív elrendezése molekulapályák EN1 rgiyam Homonukleáris kétatomos molekulák kölcsönhatás nélkül - és - MO (a) és reagáló (b) [C.11]
A könyv átfogó és könnyen érthető, és ami a legfontosabb, módszertanilag korrekt bevezeti az elmélet a kémiai kötés és az eredmények alkalmazása a leírást a szerkezete és tulajdonságai vegyületek különböző osztályok. Első bemutatott pre-kvantum ötletek J. Lewis vegyértékű (Lewis ovyh) struktúrák és azt mutatja, hogy már a alapján képviseletet szocializációja elektron pár és egy egyszerű oktett szabály használatával logikus érvelés a nagyszámú kapcsolatok és hivatalos vádemelés nélkül is lehetséges, bonyolult matematikai számításokat, mint mondják az ujjakon. hogy ismertesse a szerkezete és tulajdonságai sok molekula. Lényegében ez kezdődik Bevezetés a modern kémia áthatja a véleményét, és a feltételeket a két fő megközelítés, hogy a kvantum elmélet kémiai szerkezete, a módszer a vegyértékkötéseket (BC). Sajnos, annak ellenére, hogy az egyszerűség és intuitív vonzereje ezeket a gondolatokat, és az eljárás a nap nagyon bonyolult számítási és nem teszi lehetővé minőségileg megoldani a kérdést, hogy az energia az elektronikus államok a molekulákat. amely nélkül lehetetlen megítélni körülbelül szerkezetüket. Ezért, az alábbiakban a kvantumelmélet a kémiai kötés kerül bemutatásra elsősorban keretében eltérő megközelítést-módszer molekulapálya (MO). A példában kétatomos molekulák a belépett kulcs ábrázolása MO elmélete orbitális átfedés és az energia szintje MO, kötelező jellegüket és a nyirokcsomó tulajdonságait. valamint az MO szimmetria. Mindez építési végződik általános diagramok MO és Homonukleáris kétatomos molekulák Goethe -royadernyh vita és az ő segítségükkel a szerkezete és tulajdonságai számos egyedi rendszerek egyszerre világossá válik, hogy bizonyos tulajdonságait molekulák (például mágneses) magyarázható csak az alapján a kvantumelmélet MO. Következő MO elmélet alkalmazzák poliatomos molekulákat. és bizonyos esetekben ez történik szempontjából lokalizált MO (hasonló az ötlet az irányt a Nap kapcsolatokat módszer) és a tervezési vezetünk hibridizáció atomi pályák. míg mások kénytelenek a delokalizált MO. Megbeszélés E kérdések végződik érdekes írásbeli szakasza a lehetőségeit a molekuláris spektroszkópia, hogy meghatározzuk a vegyületek szerkezetét a leírásban ismertetjük elveit rezgési spektroszkópia [C.6]
A Homonukleáris kétatomos anyag forgási összege több mint Államok Q = 50. Számítsuk számára szintű 1) az arány a molekulák számát a k-adik szint a molekulák számának a nulla szinten, 2) a frakciót (a teljes) molekulák, amelyek az 1. szinten 3) a frakció molekulák, amelyek a nulla szinten. [C.123]
Az A reakcióvázlat () azt mutatja, egymást követő lépéseket szövődménye kémiai szervezet az anyag (természetesen, a fenti rendszer mind egy töredéke az általános szervezet anyag strukt s, t. E. Extension áramkör). A rendszer (2) azt mutatja, hogy a molekuláris társult vannak kialakítva Homonukleáris vagy hetero-nukleáris molekulák, míg a atomi társult képződött atomi részecskék. megkerülve a második molekuláris szinten. Az aggregátumok képződését előfordulhat atomi két független mechanizmussal, vagy közvetlenül a sugárzó részecskéket (halad a két réteg), vagy kölcsönhatása miatt atomi társult. A legjellemzőbb példák az atomi nukleáris aggregátumok és fém rácsok [C.9]
Most kezdenek népességnövekedés elektronokkal egymás molekulapályák -By két-elektron orbitális on, és így tisztázni az elektronikus szerkezetét Homonukleáris kétatomos molekulák Li2 N62- Minden a molekulák elsősorban négy elektron, amelyek izolált atomok a belső 15-pályák 51h. A kétatomos molekula, kettő a négy belső elektronok a kötési molekulapálya a1 és a két-pályák és a antibonding on. Azonban ezek a négy elektron nincsenek hatással a kötés. így feltételezhetjük, hogy ők még mindig 1x atomi pályák. A kémiai kötés forgó molekulákban itt definiáljuk csak külső elektronok atomi szinten kvantumszámmal n = 2, ezért szükséges, hogy csak azokat molekulapályák. képződő atomi 2s és 2p pályák. [C.525]
A négyzetek ilyen funkció eloszlása határozza meg az elektronsűrűség. megfelelő minden molekulapálya. Minden schest molekulapályák mutatjuk vázlatosan látható. 13-25. Ezek közül három kötelező, és a három széteső. Az energia szintet ábrán mutatjuk be. 13-26. Megjegyezzük, hogy a példában azt tartják pályákat mutatjuk az általános szabály. miáltal orbitális a bolschoy száma nodális felületek nagyobb energiát. Az érvényességi ezt a kijelentést lehet ellenőrizni a orbitáijaihoz Homonukleáris heteronukleáris kétatomos molekulákat. obsuzhdavschihsya a fejezetben. 12, és még a hullám funkciók a hidrogénatom. [C.575]
A GT 12 megvitattuk az elektronikus szerkezet HC1 § jegyezni, hogy heteronukleáris kétatomos molekulák poláros, míg a homonukleáris dvu.chatomnye nem-poláris molekuláknak. A nem-poláris molekula egy nulla (vagy közel nulla) dipólmomentum. sok taki.h, ahol az egyéni kommunikáció között poláris poliatomos molekulákat. bár nem poláros molekula egészének. Példaként a SCC. Lj a molekula szerkezete. Ez ábrán látható. 13-28 is. Mivel klór-elektronegatívabb elemet. mint a szén, kötő elektronpár felé klóratomok. Ennek eredményeként, az egyes C-C kötést válik kis dipólus yument%. Páronkénti vektor kívül dipol kötésekkel hozamok két egyenlő nagyságú és ellentétes irányú dipól CC1 fragmensek. ábrákon bemutatott módon, 13-28, b. Szimmetrikus forma tetraéderes molekulák SSC meghatározza a nulla dipólmomentum így, I4-apoláros molekula. [C.579]
Vegyérték és molekuláris struktúra (1979) - [c.66. c.72]