Elektrolízis nátrium-klorid oldat - studopediya
Elektrolízis NaCl oldat - a legegyszerűbb és leggazdaságosabb módszer egyidejű előállítására három fő kémiai termékek - klór, hidrogén és nátrium-hidroxid-oldat alkalmazásával olcsóbb és természetes alapanyag áll rendelkezésre. Ez a leginkább nagyszabású elektrokémiai termelés. A teljes reakció az elektrolizáló lehet alábbi egyenlet fejezi ki
A klórt használnak nagy léptékű, mint nyersanyag előállítására klórozott oldószerek és műanyagok, szintetikus gumik, rostok, vegyi anyagok. A kohászati klór használt klórozására pörkölés ércek, a textil- és papíriparban - tisztítására és fehérítésére cellulóz, és a cellulóz szövet. Nagy mennyiségű klórt tisztítás és sterilizálás a szennyvíz és ivóvíz.
Nátrium-hidroxidot gyártásához használt számos vegyipari termékek, különösen az ipari szerves szintézis, a cellulóz-és papíripar, a gyártása műszál, fém (alumínium termelés), a petrolkémiai iparban, és mások.
A jelentősége a hidrogén, mint a tüzelőanyag a jövőben, és a kémiai reagens korábban említett.
Elektrolízis NaCl oldat végezzük két módszer különböző jellegű elektróda folyamatok és a hardver tervezése:
1. A szilárd eiektroiizáióceiia és szűrés membrán;
2. elektrolízis nélkül membrán egy folyékony higany katód.
Gáznemű termékek - klór és a hidrogén bármelyik módszerrel kitűnnek nagy tisztaságú. Az elektrolízis során egy higanykatódos és egy harmadik termék - a nátrium-hidroxid-oldattal erősen koncentrált nátrium-hidroxid és a kémiailag tiszta. Mivel a tisztaságát a kapott termékek, az egyszerű és kompakt hardver tervezése, valamint egylépcsős megoldás a NaCI-elektrolízis folyamat az egyetlen módszer a termelés a klór a világon, és a fő módja előállítására nátrium-hidroxid.
Elektrolízis NaCl oldatot egy szilárd katóddal és egy membrános szűrőt
Végrehajtása során ezt a folyamatot a katód összhangban értékek az elektród potenciál fordulnak elő a következő folyamatok:
Anyagok a katód az acél, amelynél a hidrogén szabadul viszonylag alacsony túlfeszültség (0,3 V). A tényleges elektrolízis körülmények között (tömény NaCl-oldattal mossuk, nátrium hidroxidot tartalmazó, hőmérséklet 90 ° C) Tényleges hidrogénatom fejlődés potenciálja körülbelül - 0,845 V. redukciós potenciálja 0,3-0,4 V lehet elérni használatával porózus grafit katódok kikeményítése és impregnált hidrofobizálására politetrafluor-etilén és aktivált réz vagy ezüst-sók.
Felhalmozódó a katód térben a hidroxid-ionok alkotnak semleges molekulák nátrium-hidroxid
Az anód, klór szabadul fel:
Az anyag a anód ruténium-oxid-rendszer (összetétele ruténium és titán-oxidok hordozós titán bázis), amely rendelkezik a szilárdság és a kémiai semlegesség tekintetében az oxigén egyik mellékterméke az anódon:
Ezen túlmenően, a nagy részét az elektrolit az anód térben a hidrolízis klórt káros kémiai reakciók:
Ebből adódóan a reakciósorozatban a hipoklorit-anion megy anódos oxidáció
Mellékhatások csökken a hozam a fő termékek a jelenlegi, és növeli az energiaellátásban együtthatók. Ezért, a feltételeket az elektrolízis és elektrolit koncentrációt kell biztosítania a minimális mellékreakciókat és a maximális kimeneti áram a kívánt termékek. Ennek a végrehajtására a elektrolízis elektrolízis cellákból függőleges folytonos szűrő-membránokat ellenáramú mozgását az elektrolit és az OH - ionok. Reakcióvázlat elektrolizáló ábrán látható. 1.
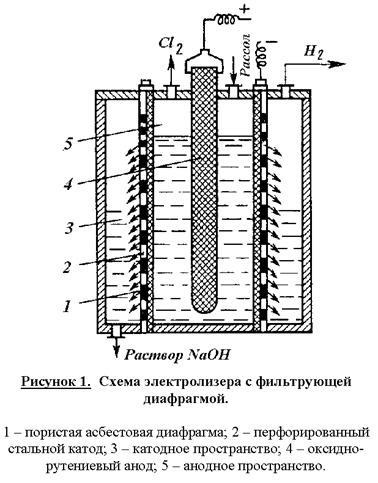
Ház fürdőt ebben a kiviteli alakban van osztva egy katód és egy anód térre egy porózus membrán azbeszt módosított polimer anyagok. Rekesz feszes a perforált üveg katód. A modern elektrolizáló katódokat elágazó fésű alakú terv felülete fejlődését. A anód térben jelentése ruténium-oxid anód. Tisztított sóoldattal táplált az anódtérbe, és egy szűrőn keresztül a membrán és a katód a katód szegmensbe miatt hidrosztatikus nyomás. A katódos térben folyamatosan távolítjuk hidrogénatom és nátrium-hidroxid-oldatot, és az anód a - klór. A képződött klór-gázt tartalmaz 95-96% Cl2. Klórgáz lehűtjük 20 ° C-on (a kondenzált víz), és tovább szárítottuk mosással tömény kénsavat. Katód termék - a nátrium-hidroxid-oldatot tartalmaz, 120-140 g / l nátrium-hidroxid és 170 - 180 g / l mennyiségű el nem bomlott NaCl. Az oldatot bepároljuk, és a nátrium-klorid eljár szilárd fázisban annak oldhatóságától csökken meredeken növekvő NaOH koncentráció. Lepárlása után Alkohol és az olvadó, vízmentes nátrium-hidroxid-oldatot készítünk, amely 92-95% -os NaOH, és a 2 - 4% NaCl.
Mivel a visszaáramlás elektrolit ionok és OH -. tart gyakorlatilag nem esik a anód- és oldalsó (5) reakcióban, (7) - (9), melyek ezek felelősek, rendkívül minimalizálható.
Elektrolízis nátrium-klorid-oldat higanykatódos
A higanykatódos, az elektród reakciók (1) és (2) magas túlfeszültség - kisülési potenciálja 1,7-1,8 V. Nátrium kiosztott egy higanykatódos egy nagy depolarizációs hatás és a kisütési kapacitása Na + higany sokkal alacsonyabb, és egyenlő a standard 1,23 V a jelenség a depolarizáció higanykatódos van ellátva úgy, hogy a kisülési nátrium ionok történik az képződése kémiai vegyületek - nátrium-amalgám
amely folyamatosan kivezetjük a felületén az anód, oldott fölös mennyiségű higanyt. Egy perforált grafit (vagy ruténium-oxid) anód áll klór
nátrium-amalgámot tartalmazó 0,1 - 0,3% Na kiürített az elektrolitikus cella és a felmelegített vizet a megbontását egy külön reaktorban-bontó. A bontó egy elektrokémiai reakció, amely megfelel a folyamat egy zárlatos galvanikus elem nahG n [NaOH] C amalgám, amely arra szolgál, mint a katód
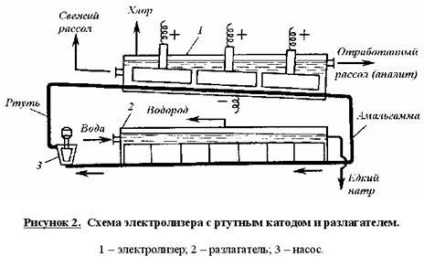
Reakcióvázlat elektrolitikus higanykatódos van a 2. ábrán látható.
Mély tisztított, koncentrált NaCl-oldatot tápláltunk a ferde hosszúkás elektrolitikus cella, amely után az alsó a gravitáció által, ellenáramú sóié, higany mozog, szolgáló katód. Higanyt vízszintes ruténium-oxid (vagy perforált grafit) anód, elmerül a sóoldattal mossuk. Az anód folyadék, amely az el nem reagált nátrium-klorid, származó sejt együtt a klór-gáz, amely el van különítve a szeparátor és a leürítő oszlopok (nem látható az ábrán). A klórt táplálunk a szárítás és tisztítás után obeskhlorenny sóié és a higany szennyeződéseket telített kősó és visszatért be az elektrolitikus cellába. nátrium-amalgám áramlik a sejt juttatnak egy ferde reaktorba-dekomponista, ami mozog ellenáramú desztillált vízzel, szolgáltatott olyan mennyiségben, hogy megkapjuk a 45% nátrium-hidroxid-oldattal th. Alján a bontóban van fésű grafit képező lemez amalgám rövidrezárva elektrokémiai cella nahG n [NaOH] C. A kiürített nátrium-hidroxid elválasztjuk a szeparátorok a hidrogén és a továbbított a fogyasztók számára. Mercury eredő dekomponista, higany pumpálnak az elektrolizáló.
Amint lépésben alkáli elektrolízis nem termelt, ezután a higanykatódos kizárt mellékreakció (5), (7) - (9), és a folyamat jellemző a magas jelenlegi hatékonyságát és energia.
Azonban, elektrolízis módszer higanykatódos igényel, különösen alapos tisztítása a forrása a keringő sóoldattal mossuk, mivel a szennyező magnézium, vas, kalcium, és más fémek, hogy csökkentsék a hidrogén túlfeszültség higanykatódos, ami ahhoz vezethet, hogy zavar a katód folyamat és a robbanások.
Higanykatód elektrolízis ad erősen koncentrált vegytiszta oldatok nátrium-hidroxidra van szükség a különböző fogyasztók, elsősorban a szintetikus szálak, a szintézis és előállítását ioncserélő anyagok, és mások. Azonban, a higany használata káros az emberi egészségre. Ahhoz, hogy kémiailag tiszta oldatokat NaOH kezdte alkalmazni elektrolízis NaCl oldatot egy ioncserélő (kationcserélő) membránt, amely elválasztja a katód és az anód terek. Ez a módszer sokkal nehezebb hardver tervezése és berendezés működtetéséhez, de sokkal biztonságosabb, mint a higany. Membrános elektrolízis eljárás, valamint a membrán, lehet tekinteni hulladékszegény folyamatot.