kolloidkémia
Befolyásoló tényezők PFC
CMC számos tényezőtől függ, hanem elsősorban határozza meg a szerkezet egy szénhidrogéncsoport, a természet a poláros csoportot, különböző adalékokat az oldathoz, és a hőmérséklet az anyagok.
A hossza a szénhidrogéncsoport R.
A vizes oldatok - a homológ sor szomszédos homológok arány ≈ 3,2 CMC értéke együttható szabályok Traube-Duclos. A nagyobb R, annál nagyobb az a rendszer energiája csökken, ha micellaképződés, azonban a hosszabb a szénhidrogéncsoport, az alsó CMC.
Az a képesség, hogy nyilvánvaló a szövetség felületaktív molekulák R> 8-10 szénatomot S. elágazó telítetlenséget, ciklizáció csökkenti a tendencia, hogy MTSO ↑ és a CMC.
A jelenléte ionos csoportokat növeli az oldékonyságot a felületaktív anyag vízben, ezért ionos átmenetifém molekulák a micella nyert kevesebb energiát, mint a nemionos molekulák. Ezért CMC ionos felületaktív anyagok általában magasabb, mint a nem-ionos, hidrofób jelleg a molekula ugyanazon (beleértve a szénatomok a láncban).
Az adalékanyagok hatása az elektrolitok és a poláris szerves.
Bevezetés az elektrolitok megoldások IPAV és Nipah okozza egyenetlen hatást:
1) megoldások IPAV ↑ ↓ Sal-ta CMC.
A fő szerepet játszik a koncentráció és ellenvád. Valószínű töltött ionok a felületaktív ion az MC, kevés hatása van a CMC.
Relief MTSO magyarázható kompressziós diffúziós réteg ellenionok gátlási disszociációs felületaktív molekulák és részleges dehidratálásával felületaktív ionok.
Süllyesztése micella díj gyengíti az elektrosztatikus taszítás és csatlakozásának elősegítése új molekulák micella.
Abban ICR Nipah elektrolit additív hatás kicsi.
2) Az elegyhez a szerves anyagok felületaktív anyagok vizes oldatában másképpen befolyásolja CMC:
kis molekulatömegű vegyületek (alkoholok, aceton) ↑ PFC (ha nem szolubilizálja)
hosszú szénláncú vegyület ↓ CMC (micellák ellenállás növekszik).
3). A hőmérséklet hatása T.
Van egy másik karaktert a befolyása T IPAV és nipa.
A növekedés a T IPAV megoldásokat növeli a termikus mozgás és aggregálódásának megakadályozására molekulák, de intenzív mozgás csökkenti a hidratációs a poláros csoportok és elősegíti azok Association.
Számos felületaktív nagy R, mert a rossz oldhatósága nem micelláris oldatokat. Azonban, amikor a változó T felületaktív növelheti az oldhatóságot és a detektált MTSO.
T egy macska. IPAV oldhatósága következtében nő a kialakulását MC nevezett Krafft pontja (általában 283-293 ° C).
T. Krafft TPL nem egyezik meg a TV-t. Felületaktív anyag és alatt helyezkedik el, mert duzzadt gélt felületaktív hidrát és ez megkönnyíti olvadó.
Ábra. 7.2. A fázisdiagramja a kolloid oldat szempontjából a felületaktív anyagok a következők közelében Krafft
A felületaktív anyagok alacsony Krafft pont értéke:
a) beviszünk egy további CH3 - vagy függő szubsztituenseket;
b) bevezetésére telítetlenség "=";
c) a poláris szegmens (oxi-etilén) között egy ionos csoport és a lánc.
A fenti pontok a tutaj MC IPAV szétesik kisebb társult - ott demitsellizatsiya.
(Micellaképződést történik egy adott felületaktív minden egyes hőmérséklet-tartományban, ami fontos jellemzői Krafft pont és a zavarosodási pont.
Krafft pont - az alsó határértéket micella ionos felületaktív, ez általában 283 - 293 K; alatti hőmérsékleten szerek Krafft-pontja a oldhatósága a felületaktív anyag nem elegendő, hogy micellák.
Cloud Point - a felső hőmérsékleti határ micella, nemionos felületaktív anyag, a hagyományos értékeinek 323-333 K; magasabb hőmérsékleten a felületaktív rendszer - oldószerben instabillá válik, és rétegezett két makrofágok).
2) ↑ T ↓ Nipah CMC megoldások miatt a kiszáradás a oxietilén láncok.
A megoldások Nipah megfigyelt zavarosodási pont - a felső hőmérsékleti határ MTSO Nipah (323-333 K), a magasabb T rendszer instabillá válik, és rétegezett két fázisra.
Termodinamika és micellaképződés mechanizmus (MTSO)
(Felületaktív True oldhatóság növekedése miatt a entrópia, amikor oldott S kisebb mértékben reagáltatjuk vízmolekulák.
, S jelentős azok oldódási IPAV jellemezve disszociációs vízben.
Nipah kölcsönhatásba gyengén a H2 O, ezek oldhatósága kisebb, ugyanabban az R. legtöbb? H> 0, azonban amikor az oldhatóság ↑ ↑ T.
Sekély felületaktív oldhatósága megjelenik a „+” felületi aktivitás, és egy C ↑ - szignifikáns kapcsolatot a felületaktív molekulák átjutását MTSO. )
Nézzük meg a mechanizmus a felületaktív feloldódást. Ez két szakaszból áll: egy fázis átmenet és kölcsönhatás oldószer molekulák - szolvatáció (hidratáció és víz):
ΔNf.p.> 0 ΔSf.p.> 0 ΔNrastv.> 0 és ΔG szol. -3 mol / l), kiindulva CMC, micellaképző ionos körül diffúz ellenion réteget, a függőség = f () megtört, és a vonal törés figyelhető meg.
Egy másik eljárás annak meghatározására, a CMC mérésén alapul a felületi feszültség a felületaktív anyag vizes oldatában, amely csökken a növekvő koncentrációja egészen a CMC, majd lényegében állandó marad. Ez a módszer alkalmazható mind ionos, mind nemionos felületaktív anyagok. Annak meghatározására, CMC, attól függően, hogy a kísérleti adatok a C jellemzően a koordinátákat = f (LNC) (ábra. 7.3).
Izotermák σ = f (C) izotermák különböznek a valódi oldatokat felületaktív élesebb ↑ ↓ σ C és a jelenléte a törés, alacsony koncentrációban (mintegy 10 -3 - 10 -6 mol / L), amely felett állandó marad σ. További drámai, ezen a ponton LSP érzékel az izoterma σ = f ln (C) összhangban
A telek a törésmutatója n a koncentrációja a felületaktív anyag oldata egy szaggatott vonal a két szegmens metszik a ponton LSP (ábra. 7.4). Ezzel függőség tudjuk meghatározni a CMC felületaktív anyagok vizes és nem-vizes közegben.
Az ECR igaz (molekuláris) oldatot átvittük egy kolloid oldat, ezáltal jelentősen növelve a fényszórási rendszer (lehetett megfigyelni szétszórt fény porszemcsék a levegőben lebegő). Annak meghatározásához, CMC fényszórással mért optikai sűrűség D rendszer függően a felületaktív anyag koncentrációja (ris.7.5) LSP generálódnak D = f (C).
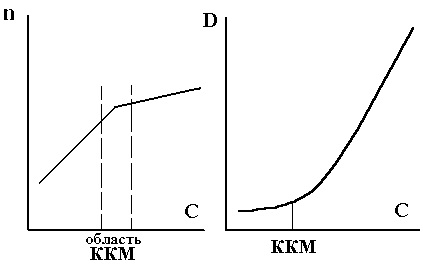
Ábra. 7.4. Meghatározás CCM mérésére szolgáló eljárást a törésmutató n.
Ábra. 7.5. Meghatározása a CMC fényszóródással (jobbra).