inzulin receptor
Az inzulin receptor (IR) (Eng inzulin receptor.) - transzmembrán receptor. által aktivált inzulin. IGF-I. IGF-II tartozik nagy csoportját a receptor tirozin kinázok [1]. Metabolikusan, inzulin receptor szerepet játszik a szabályozás a glükóz homeosztázis, a funkcionális folyamat, amely a degeneratív állapotok vezethet számos klinikai manifesztációk, beleértve a rákot és a cukorbetegség [2] [3]. Biokémiailag inzulin receptor által kódolt egyetlen gén INSR, alternatív splicing során transzkripcióját, amely gyárt akár az IR-A vagy az IR-B izoforma [4]. Az ezt követő poszttranszlációs esemény minden izoforma képződéséhez vezet a proteolitikusan-split α és β-alegységekből, amelyek, amikor együtt, végül képes dimerizációra, így diszulfid-kapcsolt transzmembrán inzulin receptor tömeg ≈ 320 kDa [4].
Kezdetben átiratok INSR alternatív illesztési variánsok a gén lefordítható, hogy az egyik a két monomer izomer: IR-A, ahol 11-es exon van vágva, és az IR-B, ahol az exon exon 11. A felvétel a 11 a 12 aminosavból eredmények hozzáadásával a fenti egy furin proteolitikus hasítási helyet felosztása.

Color-kódolási séma az inzulin receptor
Amikor a receptor dimerizációját, miután proteolitikus hasítása α- és β-lánc, amelyek egy további 12 aminosavat a C-terminális α-lánc (kijelölt αCT), ahol feltehetően kölcsönhatását befolyásolják receptor és ligandum [5].
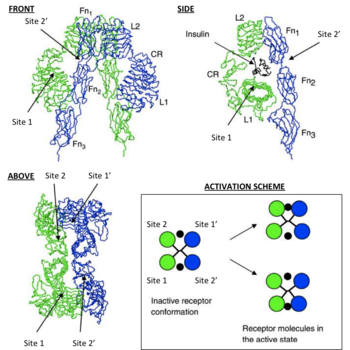
Mindegyik monomer szerkezeti izomer osztva 8 különböző területeken; leucin-dúsított domén ismétlődések (L1, maradékok 1-157) cisztein-gazdag régió (CR, maradékok 158-310), a további leucin-dúsított domén ismétlődések (L2, maradékok 311-470), három fibronektin III típusú domén; FnIII-1 (aminosavak 471-595), FnIII-2 (maradék 596-808) és FnIII-3 (maradék 809-906). Továbbá, a beszúrási domén (ID, maradékok 638-756) belül helyezkedik FnIII-2, amely egy hasítási hely α / β furin, amelyek hatnak proteolízis IDα és IDβ domének. A β-lánc, az alábbiakban a területen FnIII-3 a transzmembrán hélix és az intracelluláris juxtamembrán régióban, közvetlenül a fölött a intracelluláris katalitikus tirozin kináz domént felelős az intracelluláris jelátviteli útvonalak [6]. Azáltal felosztása a monomer megfelelő a- és β-lánc receptor homo- vagy heterodimerizálódnak keresztül kovalens diszulfid kötés a monomerek és két diszulfid-kötést, mindegyik kiáll a α-lánc dimer. Az általános szerkezet 3D-ektodomén [en]. négy ligandum kötő helyek, hasonlít egy fordított V Mindegyik monomer forog körülbelül 2-szer egy tengely körül párhuzamosan húzódó fordított V L2 és FnIII-1 domének az egyes alkotó monomer tetején a fordított V [6] [7].
Az endogén inzulin-receptor ligandumok közé tartozik az inzulin. IGF-I és IGF-II. A ligandum kötődése a láncok a α-IR ektodomén okoz strukturális változások a receptor, ami a különböző autofoszforilezését tirozin maradékok az intracelluláris domén TK β-lánc. Ezek a változások sposobstvovuyut toborzása specifikus adapter fehérjék [en]. fehérjék, mint például az inzulin receptor szubsztrát (IRS) mellett a SH2-B [en] (Src homológja 2 - B), az APS és protein foszfatázok, mint például a PTP1B [en]. végül hozzájárulva a későbbi folyamatokat vércukor homeostasis [8].
A vázlat a potenciális kötőhelyet IR
Szigorúan véve, a kapcsolat az inzulin receptor és a ligandum mutatják komplex allosztérikus tulajdonságait. Ezt jelzi az ütemezés Scatchard [en], amely azt mutatja, hogy a mért érték az inzulin receptor, kötött ligandum, viszonyítva a nem kötött ligandum nem lehet egy lineáris függvény változásai tekintetében az inzulin receptor koncentrációk kapcsolódó ligandum, amely egy ok arra, hogy feltételezzük, hogy az inzulin receptor és ligandum reagáltatjuk mechanizmussal együttműködve kötött [en] [9]. Ezen túlmenően, az a megfigyelés, hogy a disszociációs ráta IR-ligandum növekszik azzal a kiegészítéssel, nem kötött ligandum azt sugallja, hogy a jellege ezen együttműködés negatív; Más szóval, a kezdeti a ligandum kötődését infravörös gátolja a további kötési amelynek második aktív hely, bizonyítva a allosztérikus gátlását [9].
Bár a pontos mechanizmusa IR kötődését annak ligandum szerkezetileg még nem tisztázott, a szempontból a rendszerek biológia. biológiailag értelmes becslés kinetikája [en] IR-ligandum (inzulin / IGF-I) már meghatározott keretében jelenleg rendelkezésre álló szerkezetek ektodomén IR [6] [7].
Ezek a modellek azt állítják, hogy az egyes monomer 2 IR inzulin kötőhely; Oldal 1, amely kötődik a „klasszikus” felületi kötődését inzulin. álló L1 plus αCT domént és helyén 2 álló hurkok találkozásánál FnIII-1 és FnIII-2, megjósolható, hogy kötődnek az „új” arc hexamer inzulint kötőhelyet [1]. Mivel mindegyik monomer biztosít IR ektodomén képviseletét 3D «tükör” komplementaritás, N-terminális helyén 1 egy monomer végül szembesül a C-terminális helyén 2 a második monomer, amely szintén igaz minden tükörre monomerek komplement (a szemközti oldalon a ektodomén szerkezet) . Jelenlegi szakirodalomban megkülönböztetik kiegészítéseket kötőhelyek, hozzárendelése telek 1 és 2 monomer kiegészítéseket helyszínek, mint a 3. és 4. vagy az telek 1 „és 2”, illetve [1] [10].
Így, ezek a modellek azt állítják, hogy az egyes IR kötődni képes az inzulin molekula (amely két kötési felület) a 4 helyen telephelyek által az 1, 2, (3/1 „) és (4/2”). Mivel minden egyes telek 1 proximális felé a telek 2 előrejelzések történni inzulin kötődés helyspecifikus „tűzés» [en] ligandum által monomerek közötti (azaz [monomer 1 Oldal 1 - inzulin - monomer 2 hely (4/2 " )] vagy [1 helyén monomer 2 - inzulin - 2-site monomer (3/1 „)]). Összhangban a matematikai modellezése IR-inzulin kinetika, két fontos következményei térhálósító eseményeit inzulin; 1. A fenti megfigyelés a negatív kölcsönhatást IR és annak ligand kötődés után a ligandum az IR-csökkenés és 2. fizikai expozíciós térhálósodást eredményez az ektodomén egy olyan konformációban, amely szükséges a kezdeti intracelluláris tirozin foszforilezési események (azaz azok az események olyan követelmény receptor aktiválás majd fenntartásával homeosztázisát vércukorszint) [8].
A receptor tirozin-kinázok [en]. köztük az inzulin receptor, közvetítik az aktivitást okozva a mellett a foszfát csoportot egy specifikus tirozin-sejtekben bizonyos proteinek. A „szubsztrátum” fehérjék, melyek foszforilezzük az inzulin receptor tartalmaz egy fehérje úgynevezett «IRS-1" a„inzulin receptor szubsztrát 1”. Kötés és foszforilációja IRS-1 végül növekedéséhez vezet a nagy affinitású molekulák glükóz transzporter (GLUT4) a külső membrán inzulin érzékenységet a szövetek, beleértve a izomsejtek és zsírszövet. és, következésképpen, hogy növelje a felszívódást a vér glükóz ezekben a szövetekben. Más szóval, a glükóz transzporter GLUT4 hólyagocskák szállítják sejtről sejtre felület, ahol meg lehet majd közvetíteni a közlekedés a glükóz a sejtbe.
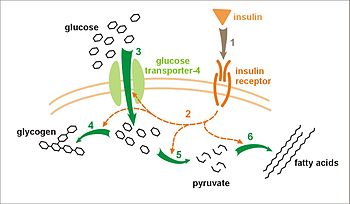
Inzulin hatása giukózfeivéieiének és az anyagcserét. Az inzulin receptorához kötődik (1), amely viszont, kiváltja a aktiválását számos fehérje kaszkádok (2). Ezek a következők: transzlokáció Glut-4 transzporter, hogy a plazmamembrán, és beáramlása glükóz (3) glikogén szintézis (4), glikolízis (5), zsírsav szintézis (6).
A fő tevékenysége az inzulin receptor aktiválása - indukált glükóz felvételét. Emiatt „inzulin érzéketlen” vagy csökkentése inzulin receptor jelátviteli vezet 2. típusú cukorbetegség - sejtek nem tudják, hogy ennek eredményeként a glükóz és - hiperglikémia (vércukorszint emelkedéséhez forgalomba), és minden következményével a cukorbetegség.
Több beteg homozigóta mutációt INSR géneket ismertetnek például éppen vett Donohue szindróma [en]. Ez egy autoszomális rendellenességek csinálni egyáltalán nem funkcionális inzulin receptorokkal. Ezek a betegek egy alacsonyan fekvő, gyakran kiálló, fül, orr, vastag ajkak, és erős növekedési visszamaradottság. A legtöbb esetben a prognózis ilyen betegek rendkívül rossz, a halálozási bekövetkezik az első életévben. Más mutációk ugyanabban a génben kevésbé okoz súlyos szindróma Robson-Mendenhall [en]. amelyben a betegek jellemző az abnormális fogak, az íny és hipertrófiás expanziós tobozmirigy. Mindkét betegség fluktatsiyu glükóz: glukóz kezdetben nagyon magas az étkezés utáni, majd hirtelen esik abnormálisan alacsony szintje [11].
A génexpresszió szabályozása
Az aktivált IRS-1 funkciót, mint egy második messenger egy sejtben, hogy stimulálja a gének transzkripcióját insulinoreguliruemyh. Először is, a fehérje a Grb2 kötődik P-Tyr IRS-1 maradék SH2 domént [en]. Grb2 válik képessé, hogy kapcsolódnak SOS, ami viszont katalizálja a csere a GDP GTP-vel kötődik a Ras, G-protein. Ez a fehérje azután elindít egy foszforilezési kaszkádot, ami aktiválja a protein-kináz mitogenoaktiviruemoy (MAPK), ami belép a sejtmagba, és foszforilálja a különböző transzkripciós faktorok nukleáris (pl, Elk1).
A stimulálása glikogén szintézis
Glikogén szintézis és a stimulált inzulin receptor keresztül IRS-1. Ebben az esetben, ez a SH2-domént [en] a PI-3-kináz (PI-3K [en]), amely kötődik a P-Tyr IRS-1. Most aktiválja PI-3K tudja alakítani lipid membrán foszfatidilinozitol 4,5-bifoszfát [en] (PIP2) a foszfatidil-inozitol-3,4,5-trifoszfát [en] (PIP3). Ez közvetett módon aktiválja a protein-kináz-PKB (Akt) foszforiláció révén. PKB követően foszforilezi több célfehérjét, beleértve a glikogén szintáz kináz-3 [en] (GSK-3). A GSK-3 a felelős foszforiláció (és ennélfogva deaktiválás) glikogén-szintáz. Amikor foszforilálják GSK-3, ez le van tiltva, és megakadályozta a deaktiválása glikogén szintáz. E kitérő inzulin fokozza a glikogén szintézisét.
Miután az inzulin molekula kapcsolódik egy receptor, és aktiválja azt, akkor kerül vissza az extracelluláris környezetbe, vagy romolhat a sejtben. Lebomlás jellemzően magában endocitózis inzulin-receptor komplex, majd az enzim, amely elpusztítja az inzulin. A legtöbb inzulin molekulák bomlanak a májsejtekben. Úgy becsülik, hogy egy tipikus inzulin molekula degradálódik után körülbelül 71 perc után az első kiadás a véráramban [12].