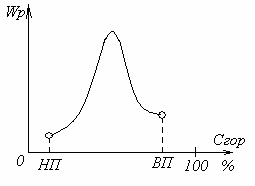
A kémiai reakció sebességét az égés és a függés a különböző tényezők
Általában egy egyensúlyi állapotot érünk el az égés ipari üzemanyag. A reakció sebességét úgy határozhatjuk meg, bármely az átváltási árfolyam a reagensek, így az égési sebességet lehet kifejezni fogyasztás mértéke a fűtőelemek vagy a tüzelőanyag, mint egész, valamint az oxidálószer fogyasztás mértéke vagy üteme égéstermékek.
A függőség hőmérséklet kémiai reakció sebessége
Növekvő hőmérséklettel, az égési sebessége a kémiai reakció növeli. Ahhoz, hogy megtalálja a sebesség egy kémiai reakció hőmérséklettől függően elegendő meghatározni a hőmérsékletfüggését állandók. Ez a függőség fejezi ki az Arrhenius törvényt.
ahol E - aktiválási energia (kJ / mól), R - gázállandó (8,314 kJ / mól), KO - pre-exponenciális faktor (teljes száma molekuláris ütközések), T - abszolút hőmérséklet a folyamat.
Az energia elegendő ahhoz, hogy megtörje a intramolekuláris kötések a kiindulási anyagok az úgynevezett aktiválási energia. Minél magasabb a szintje aktiválási energia, annál lassabb a reakció sebességét.
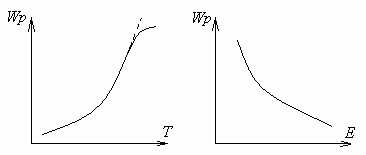
1.7 ábra - függése reakciósebesség a hőmérséklet és az aktiválási energia
Az aktiválási energia a legfontosabb tényező, ami meghatározza a reakció sebessége: minél kisebb az aktiválási energia, annál nagyobb a sebesség.
A függőség a kémiai reakció sebessége a koncentrációja a keverék