bioszintézisét hormonok
Kialakulása az elsődleges szerkezete protein hormonok vagy prohormonok-peptid kezdetben - a közvetlen következménye a transzlációs nukleotidszekvenciák a megfelelő mRNS szintetizált aktív régiók a genom hormon-termelő sejtek. A szerkezet a legtöbb hormon vagy protein prekurzorai képződött poliszómák általános rendszerében fehérje bioszintézis (ábra. 26).
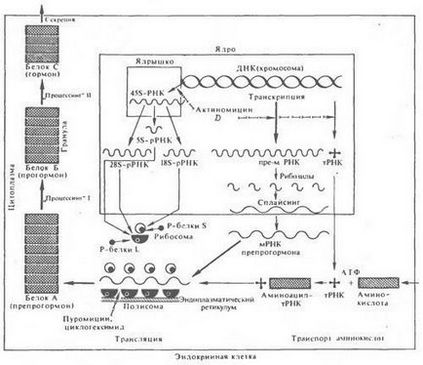
Ábra. 26. A fehérjeszintézis állati sejtek
Szintetizált fehérje poliszómák belső elválasztású mirigy sejtek - leggyakrabban krupnomolekulyarnyh prekurzor peptid hormon (preprohormone)
Ily módon lehetőség az mRNS szintéziséhez és fordítása ennek hormon vagy prekurzorainak a specifikus nukleáris eszközök és poliszómák adott sejttípusban. Így az inzulin és prekurzorainak előállított különösen a sejtek a Langerhans-szigetek a hasnyálmirigy, glukagon - a saját jól sejtek, növekedési hormon - kis eozinofilek elülső hipofízis prolaktin - nagy eozinofil sejtek az azonos rák, és gonadotropin - specifikus bazofil sejtekben és stb
Kivételt képez az általános szabály biogenezisét pályái hormon bioszintézis polipeptidek, mint felszabadító faktorok sejtjeiben a hipotalamusz, mind TRF és LH-RH. Szintézise ezek a kis peptidek nem fordul elő poliszómák a mátrixban mRNS és az oldható része a citoplazma hatása alatt különleges minden egyes faktor RF szintetáz-rendszerek, amelyek egy sor specifikus enzimek (Rayklin és munkatársai 1972-ben, 1973 ;. Johansson és munkatársai 1973).
Egy élő adás a genetikai anyag a szintézis a legtöbb polipeptid-hormonok gyakran vezet a kialakulását a hormon önmagában nem, és annak inaktív prekurzorok - preprohormone polipeptid (pregormony).
Ilyen esetekben, a polipeptid hormon bioszintézis két fázisból áll: 1) a riboszomális szintézisét inaktív prekurzor RNS templát és 2) egy poszt-transzlációs képződése az aktív hormon. Az első szakasz következik be szükségszerűen a sejtekben a belső elválasztású mirigyek, a második - hajtjuk végre általában a belső elválasztású mirigyek, de előfordulhat kívül.
Poszttranszlációs aktiválását hormon prekurzorok (proteinek előállításánál) lehet megvalósítani két formában: multi enzimes lebontás molekulák sugárzott krupnomolekulyarnyh prekurzorok csökkenő mérete a molekula (vagy molekulák) aktiválható hormon (vagy hormonok), és mivel a nem-enzimatikus Association progormonalnyh alegységek bővítés méretek aktiválható hormon molekula . Ezek az utak az oktatás nem egyediek, hogy a hormonok, hanem más szekretált fehérjék (Neurath, 1977).
Az első forma poszt-transzlációs aktiválás történik leggyakrabban a többlépcsős folyamat, végre részvételével specifikus proteázok korlátozott lépéseket. Ennek eredményeképpen az adás közvetlen genetikai szabályozás, ilyen esetekben krupnomolekulyarnyh, rövid életű elődje preprohormone. Ez tipikusan egy hidrofób N-végén, és könnyen be tud hatolni a membránon keresztül az endoplazmás retikulum, amely összefüggésbe hozható a együttesek szintetizáló poliszómák.
Amikor áthalad a membránon retikulumban történik enzimatikus hasítással pregormona hidrofób része annak N-vége a molekula és tartányban kialakítva retikulumban csonkolt molekula több hidrofil és prohormon. Prohormon mozog a folyadék része a citoplazmában (citoszol) a szekréciós granulátum, vagy a vérbe, mint egy úgynevezett „nagy” hormonok. A vér észlelt, különösen a „nagy” inzulin „nagy” növekedési hormon, a „nagy” PTH stb (Yalow, 1978, 1979).
A granulátumok az endokrin sejtek vagy kívül a prohormon lebomlik aktivált, és lesz egy igazi hormon. Azonban, az aktív hormon lehet ismét egy prohormon más hormonális vegyületek és alakítjuk abban az intézkedés alapján proteázok perifériás szövetekben. Reakcióvázlat eljárást általános formában a következők szerint:
Reakcióvázlat bioszintézis fehérje-peptid hormonok
A proteázok korlátozott elvégzett műveletek közvetített genetikai szabályozását bioszintézisének hormonok ilyen típusú.
A második forma poszt-transzlációs aktiválódását rendszerint belül végrehajtott endokrin sejtek és jellegzetes dimer glikoprotein hormonok. Ezt a folyamatot a következő:
A második forma poszt-transzlációs aktivációs
Felhelyezése szénhidrátmaradékok voltak a alegység egy enzimatikus folyamat. Továbbá, mindegyik alegység enzimatikusan hasítódik a prosubedinitsy.
Az első forma aktivált prekurzorok peptidhormonok alaposan tanulmányozták a bioszintézis inzulin, paratiroid hormon, angiotenzin, a-lipotropina, ACTH, és számos más fehérje és peptid hormonok. Tekintsük a példa a folyamatok biogenezisében inzulin a sziget-sejtek berendezés hasnyálmirigy (Steiner és mtsai. 1969 1976). Az első lépésben a hormon szintézisét sejt poliszómák rövid szintetizált egyláncú álló peptid aminosav 104-110, egy Mw-11500.
Ez a rövid életű fehérje, nem rendelkezik biológiai aktivnos / yu nevezték preproinzuiin vagy preinsulinom. Az, hogy egy / N-lánc végén egy hidrofób szignál peptid 23-tagú párosul-lánc a jövő inzulin (30 aminosav) a C-terminális közelében van a-tssp inzulin (21 aminosav), és a B és A lánc Ez interkalált peptid (30-35 maradékok különböző fajok) (ábra. 27). Szignálpeptidek változtatható és interkalált különböző állatfajokban. A tartályok durva retikulum az úton a poliszómák a preproinzulin szekréciós granulumok először vetjük alá proteolízis az N-végén, ahol a hasított szignál peptid 23-tagú, „magával rántja” pregormon a membránon keresztül.
Ennek eredményeként, a preproinzulin, proinzulin alakítjuk - egyszálú polipeptid, amely aminosav-maradékok 81-86 (MM - 9500), és alacsony a biológiai aktivitása. A szekréciós granulumok történik átalakítás proinzulin be inzulin enzimatikus kimetszés lépésbetét peptid. Ez a folyamat zajlik két szakaszból áll, amelyben részt vesznek a két csoport az enzimek: specifikus tripszin-szerű endopeptidáz (konvertáló enzim) okozva hasítási helyek Apr-április, és Lys-Apr; karboksipeptidazopodobnyh enzimek (karboxipeptidázok B) hasított április 3. Az 1. és Lys.
Ennek eredményeként ezeknek az enzimeknek van kialakítva egy kétszálú aktív formája inzulin (51 aminosavat, MM - 5700), a megkötő molekulát vagy a C-peptid (26-31 maradék különböző fajok). 3 molekula egy molekula arginin és lizin. ÖSSZEFOGLALÁS aktivációs mechanizmus ebben az esetben csökken a kimetszés a proinzulin molekula lépésbetét peptid, amely szükséges megnyilvánulása nagy biológiai aktivitását a kölcsönös térbeli orientációját a A és B láncok kapcsolódnak két diszulfid-hidak.
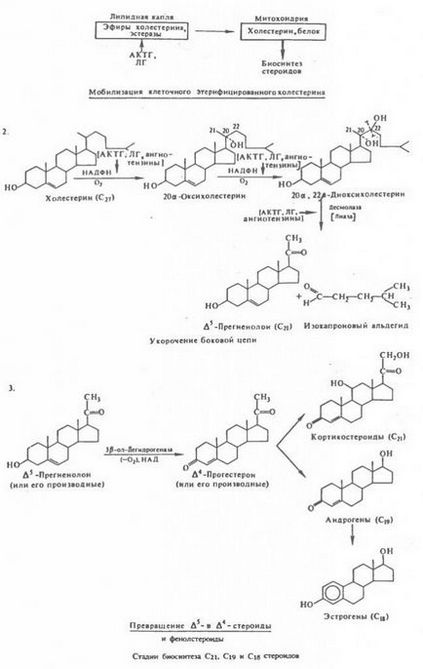
Lépés bioszintézis C21, C19 és C18 szteroidok
A leírt elv aktiváló protein-peptid hormonok bioszintézisének úgy tűnik, hogy az egyetemes, de az is változhat részletesen prekurzor molekulák és a degradáció a jellemzői a szöveti lokalizációja eljárási lépések. Így, egyláncú peptid - mellékpajzsmirigy - képződik a sejtekben a mellékpajzsmirigy szekvenciális degradációja annak krupnomolekulyarnyh prekurzorok N-vége a molekula (1974 Kemper és mtsai., 1976). A poliszómák preproparatgormon kezdetben szintetizált, tagjai 115 aminosavból. Hasítása után az N-terminális része a 25-tagú pregormona hidrofób rész képződik parathormon (90 aminosav). Tól prohormon szekréciós granulátumok mellékpajzsmirigyben kialakult sejtek hasítása után a 6-tagú N-fragmenst végétől progormonalnoy molekula.
Tól preatriopeptida (aminosavmaradék 151) van kialakítva a szívizomban első proatriopeptid kapott hasítási N-végi 25-tagú jelző molekularészt. Az utóbbi azután elhasítjuk ANF (maradékot 124-151 in pregormone) és kardiodillatin (maradékot 26-92 a előgyártmány).