Alkáli fémek - tudja, hogyan
ez a vegyérték-elektron a külső réteg alkálifém atomok le könnyen alakítja át őket a pozitív ionok egyszeres töltésű. Ez annak köszönhető, hogy az. A vegyületek alkálifémek más elemekkel szerint felépített típusától ionos kötést.
A redox reakciók alkálifémek viselkednek, mint erős redukáló szerekkel, és ez növeli a képességét, a fém-fém töltés növekvő atommag.
Között az alkáli fémek mutatnak a legmagasabb reaktivitást. Között az alkáli fémek az összes feszültség vannak elrendezve elején a sorozat. Elektronikus külső elektronikus réteg csak vegyérték-elektron, így alkáli fémek kupro vegyületek. Az oxidáció mértéke az alkálifémek általában +1.
Fizikai tulajdonságai a alkálifémek táblázatban mutatjuk be. 19.
Fizikai tulajdonságai a alkálifémek. 19. táblázat
Olvadáspont, ° C
Forráspont, ° C
keménysége
Jellemző képviselői az alkálifém nátrium és kálium.
26. ■ Készítsen egy általános jellemzője az alkálifém a következő ütemezés szerint:
a) a hasonlóságokat és különbségeket a szerkezet a alkálifém-atom;
b) a viselkedését alkálifémek redoxireakcióban;
c) A típusú kristályrács a vegyületek az alkálifémek;
g) az adott fizikai tulajdonságainak változása a fémek sugarától függően az atom. (Lásd. Response)
§ 97. Nátrium-
Elektronikus konfigurációs ls nátrium-atom 2 2s 2 2p 6 3s 1. A szerkezet a legkülső réteg:
A nátrium megtalálható a természetben csak a sók formájában. A leggyakoribb a nátrium-só nátrium-klorid nátrium-kloridot, és a KCI sylvinite ásványi · NaCl és néhány szulfátok, mint például Glauber-só Na2SO4 10H2O, előforduló nagy mennyiségben az öböl a Kaszpi-tenger Kara-Bogaz-öböl.
Táblázatból só NaCl nátrium előállított fém elektrolízisével olvasztott só. Telepítés elektrolízis ábrán látható. 76. az olvasztott só lesüllyed elektródák. Az anód és a katód által kettéosztott tér egy membrános, amely elszigeteli a kapott klórt az nátrium-a fordított reakció még nem fordult elő. Pozitív nátriumion elfogadja egy elektront a katód, és átalakul egy semleges nátrium-atom. Semleges nátrium atomok gyűjtik a katód egy olvadt fém. Előforduló a katód folyamat képviseli a következő séma szerint:
Na + + Na 0.
Mivel a katód bekövetkezik elfogadását elektronok, és bármely elektron elfogadó atom vagy ion redukció, a nátrium-ionok csökken a katódon. Abban az anód, klórionok adományozni elektronok, t. E. oxidációs folyamatot, és az elválasztás a szabad
klórgázt, amely leírható az alábbi séma szerint:
Cl - - E - → Cl 0
A kapott nátrium-fémnek ezüst-fehér színű, könnyen vágni egy késsel. A vágott a nátrium, ha a felülvizsgálat a vágás után rögtön egy fényes fémes csillogás de gyorsan elhomályosítja a rendkívül gyors oxidációja a fém.
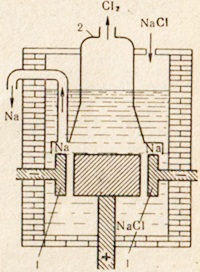
Ábra. 76. Készülék az elektrolízis olvadt só.
1 - gyűrű alakú katód; 2 - Bell a klórgáz eltávolítása céljából a anódkamrából
Ha nátrium-oxidálódik kis mennyiségű oxigén hőmérséklete körülbelül 180 °, a nátrium-oxidot kapjuk:
4NA + O2 = 2Na2O.
Az égés során oxigénben kapunk, nátrium-peroxid:
2Na + O2 = Na2O2.
Így nátrium káprázatos sárga láng égési sérülést.
Mivel a gyors és egyszerű oxidálhatósága nátrium alatt volt tárolva paraffin réteg vagy viaszt, ahol a viasz előnyös, mert kerozin mindig van némi oldott levegő mennyiségét és a nátrium-oxidációs bár lassan, de még mindig előfordul.
Nátrium adhat vegyületet hidrogénnel - hidriddel NaH, amelyben a hidrogén mutat egy oxidációs - 1. Ez a só-szerű vegyület, amely által a természet a kémiai kötés és oxidációs érték eltér az illékony hidridek elemeinek főcsoport IV-VII csoportok.
Fémnátriumot reakcióba léphet nemcsak oxigén és a hidrogén, hanem számos egyszerű és komplex vegyületek. Például, amikor zúzott egy mozsárban, és nátrium-kén hevesen reagál vele, képező nátrium-szulfid:
2Na + S = Na2S
A reakció során villog, így a habarcs távol kell tartani a szemét, és csomagolja egy törülközőt a kezében. A reakció kellene kis nátrium darabokat.
Nátrium erőteljesen égett klórt és a képződő nátrium-kloridot, ami különösen jól látható a klór-kalcium-cső, amelyen keresztül erősen melegítjük és a megolvadt nátrium-kloridot vezetünk áram:
2Na + Cl2 = 2NaCl
Nátrium reagál nemcsak egyszerű, hanem komplex anyagok, például vízzel, hidrogén szabadul ezekből. mert ez egy nagyon aktív fém elektrokémiai sorozatban sokkal bal hidrogén és könnyen helyettesíti az utolsó ki a vízből:
2Na + 2H2O = 2NaOH + H2
A megvilágított alkálifém nem szűnik vízzel. A legjobb, hogy töltse meg por szóda. Jelenlétében nátrium színtelen lángja színű sárga.
Fémnátriumot lehet használni, mint egy katalizátor a szerves szintézisek, például a szintetikus kaucsuk butadién. Ez szolgál kiindulási anyagként a készítmény más nátrium-vegyületek, mint például nátrium-peroxid.
■ 27. Igazoljuk az egyenletek a szövegben megadott reakciók fémnátriummal, úgy viselkedik, mint egy redukálószer. (Lásd. Response)
28. Miért nátrium nem tárolható a levegőben?
29. A tanuló mártott egy réz-szulfát-nátrium-darab, abban a reményben, hogy kimozdítsa a fémes réz-sók. Ahelyett, hogy fém-vörös színe kékre zselatinszerű csapadék. Írja le a reakció kialakult és írni a egyenletek a molekuláris és ionos formában. Hogyan kell megváltoztatni a feltételeket a reakció, a reakció, hogy a kívánt eredményt? Írja az egyenlet a molekuláris, teljes és csökkentett ionos formák.
30. A hajó 45 ml vízzel helyezünk 2,3 g fém nátrium. Mi a koncentráció nátrium-hidroxiddal végzett reagáltatásával kialakított befejezését.
31. Milyen eszközöket lehet használni tűz oltására bevonásával nátrium? Indokolással ellátott választ. (Lásd. Response)
§ 98. Oxigén nátrium-vegyület. marószóda
Oxigén vegyületek nátrium, mint már említettük, a nátrium-oxid Na2O és Na2O2 nátrium-peroxid.
Nátrium-oxid Na2O különleges irreleváns. Ez vízzel heves reakcióba lép, így nátrium-hidroxid:
Na2O + H2O = 2NaOH
Nátrium-peroxidot Na202 - sárgás por. Meg lehet tekinteni, mint egyfajta só a hidrogén-peroxid, mert a szerkezete megegyezik a H2O2. Mivel a hidrogén-peroxid. nátrium-peroxid erős oxidálószer. Az intézkedés alapján a víz, ez képezi egy alkálifém, és hidrogén-peroxid:
Na2O2 + H2O = H2O2 + 2NaOH
A hidrogén-peroxid alatt képződött oldást savak, nátrium-peroxid:
Na2O2 + H2SO4 = H2O2 + Na2SO4
Az összes fenti tulajdonságai nátrium-peroxid lehetővé teszi, hogy használja azt a fehérítő az összes lehetséges anyagok.
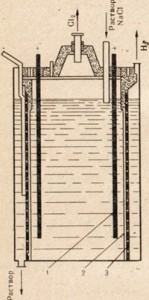
Ábra. 77. Készülék az elektrolízis nátrium-klorid oldat.
1 - egy anód; 2 - membrános elválasztó az anód és a katód rekesz; 3 -katod
Nagyon fontos, nátrium-vegyület nátrium-hidroxid vagy nátrium-hidroxid, nátrium-hidroxid. Úgy is nevezik, nátrium-hidroxid, vagy egyszerűen maró hatású.
A nátrium-hidroxidot használunk nátrium-klorid - a legolcsóbb természetes nátrium-vegyületet oly módon, hogy elektrolízis, de ebben az esetben az olvadék nem használják, és a só oldatot (77. ábra). Leírás Elektrolízis sóoldat cm. § 33. ábrán. 77 azt mutatja, hogy az anódos és katódos tér van osztva egy membrán. Ezt annak érdekében, hogy a kapott termékek nem érintkeznek egymással, például Cl2 + 2NaOH = NaCIO + NaCl + H2O.
Nátrium-hidroxid -, kristályos, szilárd anyag formájában, fehér, tökéletesen oldódik vízben. Amikor nátrium-hidroxid feloldása vízben, nagy mennyiségű hőt, és az oldatot erősen melegítjük. Marónátron kell tárolni jól lezárt konténerekben, hogy védje meg azt a vízgőz behatolásával hatása alatt, amelyek akkor erősen hidratált, valamint a szén-dioxid, a fellépés marónátron amelyek fokozatosan alakulnak egy nátrium-karbonát:
2NaOH + CO2 = Na2CO3 + H2O.
Marónátronoldat egy tipikus lúgos, ezért óvintézkedéseket dolgozni vele ugyanazok, mint ahogy azt más lúgos.
Marónátron használják számos iparágban, például olaj tisztító szappant termelési zsírok a papíriparban, a szintetikus szálak előállítását és a színezékek gyógyszerészet és munkatársai. (Ábra. 78).
• Írja be a notebook alkalmazási területén nátrium-hidroxid.
A nátrium-sókat kell jegyezni, asztali sót NaCi, amely arra szolgál, mint a fő nyersanyag előállítására nátrium-hidroxid és nátrium-fém (a részleteket az e só cm. P. 164) szóda Na2CO3 (cm. P. 278), nátrium-szulfát Na2SO4 (cm . o. 224), nátrium-nitrátot NaNO3 (lásd. o. 250) és mások.
Ábra. 78. A nátrium-hidroxid
■ 32. Ismertesse Eljárás marónátron elektrolízissel nátrium-klorid. (Lásd. Response)
33. marónátron áll rendelkezésre az intézkedés a nátrium-karbonát, oltott mész. Tedd a molekuláris és ionos Az egyenlet alakjának ebben a reakcióban, és kiszámítja, hogy mennyi szóda tartalmazó 95% karbonátot megszerzéséhez szükséges 40 kg nátrium-hidroxid.
34. Miért van a tároló oldatban nátrium-hidroxid lombikokban csiszolt dugóval parafa „megragadja”, és nem lehet eltávolítani? Ha azonban tartsa a palackot felborult a vízben egy bizonyos ideig, a csövet kivették szabadon. Magyarázza hivatkozva a reakciókat, amelyek a folyamatok zajlanak ebben az esetben.
35. Írja a reakciókat a molekuláris és ionos formák jellemző tulajdonságaik nátrium-hidroxid, mint egy tipikus lúgos.
36. Milyen óvintézkedéseket kell tenni, ha dolgozik, nátronlúg? Mi elsősegély intézkedéseket kell biztosítani arra az esetre égések marőszódával? (Lásd. Response)
§ 99. Kálium
Kálium K - is elég gyakori alkálifém, ahol a nátrium mennyiségét a atomrádiusz (negyedik periódus), és ezért magasabb kémiai aktivitást, mint a nátrium. Elektronikus kálium-atom konfigurációja 1S 2s 2 2 2 2p 6 3s 3p 6 4s 1.
Szerkezet külső elektron réteg
Kálium - egy puha fémből, amely jól késsel. Annak érdekében, hogy elkerüljük annak oxidációs, valamint a nátrium-mellett tárolva a kerozin réteget.
Kálium vízzel reagál, még gyorsabban, mint a nátrium-alkotnak az alkáli- és hidrogén-fejlődés, amely világít:
2K + 2KOH + 2H2O = H2.
Az égési oxigén (a hulladékégető ajánlott, hogy több kis darab fémnátrium, mint az égéshez), úgy, mint a nátrium, égések nagyon erőteljesen alkotnak a kálium-peroxid.
Meg kell jegyezni, hogy a keringésben sokkal veszélyesebb kálium-nátrium. Egy erős robbanás akkor is előfordulhat, ha a kálium vágva, így kezeli azt is meg kell óvatos.
kálium-hidroxid, vagy kálium-hidroxid KOH - fehér, kristályos szilárd anyag formájában. Kálium-hidroxid minden tekintetben hasonló a nátrium-hidroxid. Ezek széles körben használják az iparban szappan, de a termelési költségek drágább, így ez az alkalmazás a NaOH, ez nem az.
káliumsókat kell említeni speciálisan, mert néhány közülük széles körben használják, mint a műtrágyák. Ilyen a kálium-klorid, kálium-klorid, kálium-nitrát KNO3, ami szintén nitrogén műtrágya.
■ 37. Hogyan magyarázza azt a tényt, hogy a kálium-hidroxid kémiai aktivitása nátrium-hidroxid? (Lásd. Response)
38. A kristályosító víz csökkent kálium-szeletet. Miután a reakció vége, van hogy egy kicsit cink-hidroxid, mint amikor fehér, zselatinszerű csapadék. A csapadékot eltűnt, és amikor teszteltük fenolftaleinoldat utolsó volt festve vörös. Milyen kémiai folyamatok játszódtak le itt?
Milyen anyagokat van megoldás? Indokolással ellátott választ.
39. Miért van kálium, mint minden alkálifémek, tartozik a család s-elemek? (Lásd. Response)