A fehérjék szerkezete - studopediya
Általános fogalmak a protein folding
A folyamat kialakulásának a fehérjék három szakaszból áll:
és végül a szállítás a fehérjét a helyén a jövőbeni működés. Erre vannak speciális szabályok, és az oldatot kezd sugározni.
Translation - egymást követő beépítése aminosavak a peptidláncban építenek összhangban szekvenciáját mRNS kodonok
A fordítási folyamat magában foglalja a négy faj rRNS, melyek kombinálva vannak nukleoláris a riboszomális fehérjék, amely egy alegysége riboszómák. Ezek az alegységek a nukleáris pórusok költözött a citoplazmában. Ott is költözött sok mRNS összefüggésben különleges fehérjék és több tucat faj tRNS. Másrészt van 20 féle aminosav a citoplazmában. szintetizált magában a cellában, vagy kapott a vérből. Emellett vannak olyan 20 féle enzimek - amino-acil-tRNS-szintetáz, és a kiegészítő fehérje faktorok. Ezek az anyagok vesznek részt:
· Összecsukható feltételek - összecsukható a peptidlánc egy térszerkezet
· Módosítása - összekötő szénhidrát komponensek, oxidációját bizonyos aminosavak, stb
Azon a helyen, a végleges lokalizációját fehérjék egy sejtben vannak osztva: export, membrán, és a lizoszomális belső.
Export - azaz tervezték, hogy kiadja a sejtmembrán és a membránhoz kötött lizoszomális által termelt fehérjék, riboszómák. Ie riboszómák felületéhez rögzített az endoplazmás retikulum membrán (XPS). Ezzel a végén a szintetizált peptid behatol a belső a CSE amely azután kiderül, hogy a teljes fehérje. Az ugyanabban a térben történik hajtogatási és a fehérje módosítására. Továbbá, a szállítási és módosítások is részt más membrán szerkezetek elsődlegesen Golgi-apparátusban és végül fehérje
- vagy során felszabaduló exocitózisa a sejtek,
- tartalmazza, vagy egyik vagy másik a membrán,
- vagy van kialakítva a lizoszóma.
Ezzel szemben, a belső fehérjék (hyaloplasm fehérjék, mitokondriumok, sejtmag, stb) szintetizálódnak szabad, azaz a membranonesvyazannyh riboszómák.
Számos szintje fehérje szerkezetének: primer, szekunder, tercier és az oligomer proteinek - és negyedleges szerkezetét.
Az elsődleges szerkezet - egy szekvencia aminosav-maradékok kapcsolódnak egymáshoz peptidkötésekkel. Ez az a struktúra közvetlenül kódolt mRNS kodon szekvenciája és reprodukálni a fordítás során.
Nagyon fontos, hogy gyakorlatilag az összes 20 aminosav található meg a természetes fehérjék, van egy hasonló szerkezet tervet. Ezek tartalmazzák a háromoldalú gerincét átlagos (a-szén) atomhoz, amely kapcsolódik egy vagy másik gyökkel (R). Kapcsolódnak egymáshoz peptidkötésekkel, alkotnak folyamatos csontváz a peptid láncban. ahol háromféle kapcsolatot váltakoznak (Fig.1.1).
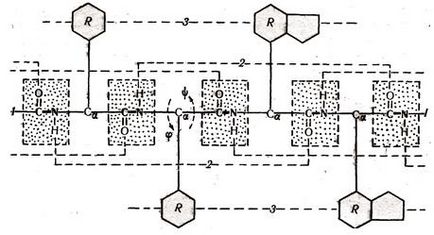
Ábra. 1.1 elsődleges szerkezete A fehérjék
Mintegy egyikük - a peptid kötés CO-NH forgatás lehetetlen. Körül a másik két -NH-Ca -Ca H és H-CO- - lehetséges elfordulását. Ez lehetővé teszi, hogy a peptid-láncot meghajlítani, alkotó másodlagos és harmadlagos szerkezet.
A másodlagos szerkezet. Kezdetben, számos fragmenst a peptidlánc szert időszakos halmozási egy adott típusa: egy-hélix és a b-szerkezetet. Ez a fajta csomagolás nevezzük másodlagos szerkezetét. különböző típusú szekunder struktúrákat, továbbá nem strukturált részek előfordulhat ugyanabban a globuláris fehérje molekula. Az arány a kettő között eltérő (1.1 táblázat).
A fibrilláris proteinek másodlagos szerkezetének tipikusan monoton. Alfa-hélix fehérjék bemutatott - miozin, tropomiozin, alfa-keratin. Ezekben a fehérjék, több lánc az alfa-hélix feltekercseltük szuperhélix. Fehérjék csak a béta-szerkezet - fibrin selyem és béta keratin (kialakítva egy-keratin kezeléssel túlhevített gőzzel).
Táblázat 1.1. A eloszlását aminosavak között a három
kiviteli alakban a másodlagos szerkezet
Egy speciális típusú másodlagos szerkezetének a fehérje kollagén, amely hasonlóságot mutat az alfa-és béta-struktúrák kollagén nevű hélix.
Az a-helix gerincet alkotó peptid lánc csavart egy spirális úgy, hogy az amino-csoportok vannak kapcsolva kifelé a hélix (1.2 ábra).
Ábra. 1.2. A másodlagos szerkezet fehérjék. Alfa-hélix
A szerkezet tartja össze hidrogénkötések között az aminosav csontvázak, és a formáció egy ilyen kötés magában foglalja -NH-csoport, egy aminosav, és -CO- - egy másik, aki a peptid-lánc elválasztjuk az első 3 más aminosavakkal. Ennek eredményeként, az egyik viszont egy-hélix van átlagosan 3,6 aminosavat. Alpha-hélixet a csak azért, mert ez a termodinamikailag leginkább kedvelt állapotban a részét a peptid láncban.
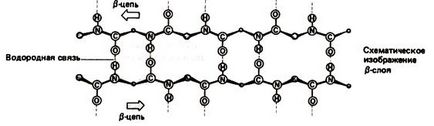
b-szerkezet - peptidlánc gerincek nem csavart egy hélix, és van egy cikcakk konfiguráció (a hajtogatott lap szerkezet 1.3 ábra). Tartanak össze hidrogénkötések között ugyanez a csapat, de most (abban az esetben, globuláris fehérjék) A konvergencia ezen csoportok és a kialakulása kötések
Ábra. 1.3. A másodlagos szerkezet fehérjék. Beta struktúra
peptidlánc ráncok alkotó 2 típusú - nagy redők eredő forgása áramkör 180 0 és kisebb lánc hajlatot egy ránc. Egymással szomszédos áramköri részletekben b-szerkezet lehet mind a parallel és antiparallel (1.4 ábra és 1,5).
Ábra. 1.4. Antiparallel áramköri részt b-struktúra
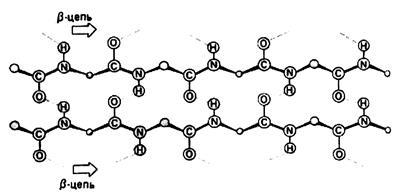
1. ábra. 5. A párhuzamos kapcsolás részletekben b-struktúra
A fibrilláris fehérjék b-hélix kialakulását hidrogénkötések bevonásával szomszédos és párhuzamos a peptidlánchoz.
A másodlagos szerkezet a fehérje vagy fragmense határozza az elsődleges szerkezete által.
Side aminosav csoportok, bár nem vesz részt stabilizáló a szerkezet a kapcsolatokat, de azt állapítjuk meg, hogy a peptid-lánc szeres az ilyen kötések kialakításához, és hogy göndör egyáltalán. Maradványok például a prolin és a hidroxi-prolin teljesen megszünteti a kialakulását a lokusz, mint az a-hélix és a b-szerkezetet. Ugyanolyan töltésű aminogyökök miatt kölcsönös taszítása nem tud közelebb egy-helix stb
A harmadlagos szerkezet. A harmadlagos szerkezet általában azt mondják, hivatkozva csak a globuláris fehérjék. Ez úgy értendő, mint a fehérje konformációjára gömböcske, azaz halmozási helyet a-helikális, b-szerkezeti és nem szerkezeti régiók a peptid láncban. Ezzel szemben a másodlagos, harmadlagos szerkezet alakul és karbantartani képződése miatt a kötések között közvetlenül amino-csoportok. A természet a kötések jellegétől függ a gyökök (1.2 táblázat).
1.2 táblázat típusai aminosav gyökök és azok képezik kapcsolatot
Beleértve 28 hidrofób és hidrofil 65
Amint táblázatból látható. 1.3, a nagy része hidrofób gyökök belül van gömböcske (amikor ezek eltérnek a vizes fázis), és a legtöbb hidrofil gyökök - a felületén. Ugyanakkor, ez a szabály nem abszolút NYM: egy bizonyos mennyiségű hidrofób csoportok a felszínen marad.
Az utóbbi nagyon fontos a kölcsönhatás a protein egy ligandummal egy hidrofób csoportot.
A formáció a harmadlagos szerkezet döntő szerepet játszik a D-fehérje a megszerzése a benne rejlő funkcionális-közi aktivitást. Általános szabály, hogy ezen a szinten a fehérje szerkezetét megjelennek az úgynevezett aktív helyeket (egy vagy több) - egy csoport több gyökök képesek spe-tsifichno kölcsönhatásba specifikus ligandumok.
Ezek a csoportok a primer struktúra szintjén, gyakran egymástól távol, és közeledik egymáshoz során csak a hajtogatás.
Azonban, a harmadlagos szerkezet van egy bizonyos mobilitást. Az alábbi tényezők befolyásolhatják az Aa gömböcskék:
- termikus ingadozások és a rezgések az egyes csoportok, amikor a kommunikáció a tört, majd ismét a lezárás kabin;
- Kémiai módosítása a fehérje (például, foszforiláció);
- fehérjét önmagában Feladatainak ellátása során.
Változások a fehérjék konformációja - a legfontosabb módszere Menenius biológiai aktivitás, ami széles körben használja-egy cellában a különböző folyamatok szabályozása.
A negyedleges szerkezet. Concept negyedleges szerkezet csak akkor alkalmazható, fehérjék, amely több alegységből áll. (Pl. Hemoglobin 4 alegysége van, 2 típus). Kvaterner szerkezet mintegy 5% fehérje, beleértve a hemoglobin, immunglobulin, az inzulin. Szinte az összes DNS-t és RNS-polimerázok negyedleges szerkezetét. Kommunikáció, alakítás és támogatja a negyedleges szerkezet, ugyanaz, mint képződése során a harmadlagos szerkezet, továbbá a hidrofób.
Az alegységek kapcsolódnak kölcsönhatása által aminosavak található érintkező felületei az alegységek. Ezek a gyökök felületi elrendezése kölcsönösen kiegészítik egymást. Különösen gyakran dúsított hidrofób és ellentétes töltésű gyökök. Így, a kötési alegység csak a kialakulását a harmadlagos szerkezet is előfordulhat. És az ilyen kötődés önmagában befolyásolja a harmadlagos szerkezete hozza, hogy egy funkcionálisan aktív vagy inaktív fehérjét. Ezért az ilyen proteinek jellemzően aktívak csak oligomer formában (hemoglobin), vagy fordítva csak disszociált állapotban (protein kináz). Ebben az esetben, az egyik alegység szolgál, hogy elnyomja a aktivitását más, és disszociál hatása alatt egy speciális jel (cAMP).