Foszfor és vegyületei
A szerkezete és tulajdonságai atomok. Következő után nitrogén képviselője főcsoport V a periódusos rendszer - foszfor elem-nemfémes R. foszfor atomok képest a nitrogénatomot egy nagyobb sugarú, elektronegativitási minimális értéket, és így nagyobb kifejezettebb csökkenését tulajdonságait. A vegyületek, amelyek egy oxidációs foka a foszforatomot -3 ritkább, mint a nitrogén (csak fosfidah - foszforvegyületek fémekkel, például Sa3R2, Na3R). A legtöbb foszforvegyületek nyilvánul oxidációs állapotban +5. De a vegyületet annak hidrogén - foszfin PH3 - a ritka esetben, ha kovalens kötés az atomok közötti különböző elemeinek a nem-poláros, mert a elektronegativitása foszfort és hidrogén közel azonos értékeket.
Foszfor - egy egyszerű anyag. Kémiai foszfor elem alkotja több allotropic módosításokat. Akikre már tudjuk, két egyszerű összetevők: fehér foszfort és vörös foszfor.
Fehér foszfor molekulatömege rács álló P4 molekulák. Vízben nem nagyon oldódik szén-diszulfidot. A levegőben könnyen oxidálódnak, és a por állapotban is meggyullad.
A fehér foszfor igen toxikus. A különlegessége, hogy képes világítani a sötétben miatt oxidáció. Tartsa a víz alatt.
Piros foszfor egy sötét bíborvörös port. Ez nem oldódik vízben vagy szén-diszulfidot. Oxidálódik levegőn lassan és magától nem gyullad. Nem mérgező, és nem világít a sötétben.
Melegítés hatására a vörös foszfor egy kémcsőbe, zárt egy vattacsomót, kiderül fehér foszfor (koncentrált pár), és ha a pull tampont fehér foszfor villog levegőn (35.). Ez a tapasztalat azt mutatja, a tűzveszélyességi fehér foszfor.
Kémiai tulajdonságait a vörös és fehér foszfor közel, de fehér foszfor több kémiailag aktív. Így mind a ketten, mint amilyennek lennie nemfémek kölcsönhatásba fémek. képző foszfidok:
A fehér foszfor spontán begyullad a levegőben, és a piros lámpa, amikor lángra. Mindkét esetben, a képződött foszfor-oxid ^) izolálunk egy sűrű fehér füst:
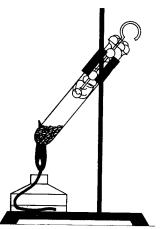
Ábra. 35. A tapasztalat mutatja vörös foszforral fehér átmenet
Mivel a hidrogén nem közvetlenül reagáltatjuk a foszfor, foszfin PH3 kaphatjuk közvetetten, mint például foszfidok a:
Sa3R2 + = 6NSl ZSaSl2 2RN3 +
Foszfin - nagyon mérgező gázok kellemetlen szagú. Fokozottan gyúlékony. Ez foszfin tulajdon és magyarázza a megjelenése mocsári vándorló fények.
foszforvegyületek. Az égési foszfin vagy foszfor van kialakítva, mint tudjuk, a foszfor-oxid-P205 - fehér higroszkópos por alakjában. Ez egy tipikus savas oxid. amelyek az összes tulajdonságait savas oxidok.
Foszfor-oxid megfelel foszforsav H3P04. Ez egy szilárd, átlátszó, kristályos anyag, jól oldódik vízben bármilyen arányban. Ahogy a hárombázisú sav, H3P04 képez három sorozat sói:
jelenti sók vagy foszfátok, mint például a Ca3 (P04) 2, amelyek vízben oldhatatlanok, kivéve a foszfátok az alkálifémek;
-sók - dihidrogén-foszfát, például Ca (N2R04) 2, a legtöbb, amelyek jól oldódnak vízben;
-só - .. hydrogenphosphates ilyen SaNR04 amelyek vízben nehezen oldódó (kivéve a nátrium-foszfátok, kálium- és ammónium-sók), azaz a közbenső közötti foszfátokat és hidrogén-foszfátokat az oldhatóság.
A természetben a foszfor szabad formában nem fordul elő - csak a vegyületek formájában. A legfontosabb természetes ásványok foszforvegyületek foszfátok és apatit. A fő tömege kalcium-foszfát Ca3 (P04) 2, ahonnan a hozam az iparban a foszfor.
Biológiai foszfor értékét. A foszfor állandó része a szövet az emberi test, állatok és növények. Az emberek, a legtöbb foszfor kötött kalciumot. A konstrukció a csontváz egy gyermeknek szüksége annyi foszfort kalciumot. Emellett csontok, foszfor és megtalálható az idegsejtekben, és az agyszövet, a vér, a tej. A növények, mint az állatok. foszfor tartalmazza a fehérjék.
Mivel elfogyasztott foszfor élelmiszerek, elsősorban a tojás, hús, tej és a kenyér, van kialakítva ATP - adenozin-trifoszfát, amely arra szolgál, mint a kollektor és a energiahordozó, valamint a nukleinsavak - RNS-t és DNS-t hordozó örökletes átviteli tulajdonságait a szervezet. A legintenzívebb ATP fogy az aktívan dolgozik a test szervei: a májat. az izmok, az agy. Nem csoda, hogy a híres minearológus, egyik alapítója a tudomány a geokémiai, akadémikus Fersman úgynevezett foszfor „eleme az élet és a gondolat.”
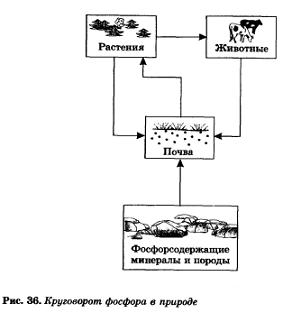
Ahogy jeleztük, a foszfor a természetben létezik a vegyületek formájában a talajban található (vagy oldjuk természetes víz). A talaj foszfor eltávolítjuk a növények és az állatok foszfort beszerezni növényi élelmiszerek. A haldoklás után a növényi és állati szervezetek foszfor ismét bejut a talajba. Így végzett foszfor körforgása a természetben (ábra. 36).
A foszfor-és vegyületei. Vörösfoszfor gyártásához használt a mérkőzések, foszforsav, amely viszont, a termelés foszfát műtrágyák és takarmány-kiegészítők haszonállatok. Továbbá, a foszfor használják peszticidek (emlékezni dobozoknak diklórfosz, triklórfon, et al.).
A felfedezés a foszfor. Foszfor fedezte fel a német alkimista H. Brand, 1669-ben és kapta a nevét, hogy képes világítani a sötétben (görög foszfor -. Luminous).
1. allotrópia foszfor fehér foszfor, vörös foszfort.
2. foszfor Tulajdonságok képződését foszfid, foszfin, foszfor-oxid (V).
3. foszforsavat és annak sói három sorozatban: foszfátok, hidrogén-foszfátok és dihidrogén-foszfátok.
4. A biológiai jelentősége foszfor (kalcium-foszfát, az ATP, DNS-t és RNS-t).
5. A foszfor és vegyületei.
Írja képlet három nátrium- foszforsav, hívja őket, és rögzíti a disszociációs egyenlet.
Írja be a reakciókat, amelyek elvégzésére a következő transzformáció:
P -> Mg3P2 -> PH3 -> P205 -> H3P04 -> Ca3 (P04) 2
Az elektronikus mérleg módszer, hogy egy reakcióegyenlet áramlik a rendszer:
P + HN03 + H20 -> H3P04 + NEM
Az iparban foszfor kapott kalcinálásával keverékét kalcium-foszfát homokkal és koksz a következő egyenlet szerint:
Ca3 (P04) 2 + 3Si02 + 5C = 3CaSi03 + 2P + 5COt
Hány kilogramm 80% -os foszforsavat nyerhetők 31 kg foszfortartalmú szennyezések 5%?
A 980 g 5% -os foszforsav oldatot feloldottuk 152 g foszfor-oxid (Y). Mi volt a tömeghányada foszforsav az oldatban?
”. Igen! Ez volt a kutya, egy hatalmas, koromfekete. De ez a kutya még egyikünk sem halandó, soha nem látott. A szájából lyukat robbant láng szeme ugrált szikrák az arc és a tarkó csillogott irizáló tüzet. Senkinek a lázas agy lehet elképzelés egy szörnyűbb, még undorító, mint a pokoli lény ugrott ki minket a köd. Szörnyű kutya, akkora, mint egy fiatal oroszlán. Hatalmas szája még mindig világított kékes láng, mélyen ülő szemei köröztek vad tűz körül. Megérintettem, hogy izzó fej és elvegyék a kezét, láttam, hogy az ujjaim is világított a sötétben. - Foszfor - mondtam. "
Ebben a részben a híres „sátán kutyája” A. Doyle jelentősen hibát vegyi anyag. Nevezze el.
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.