Tárgy - 7 megoldások, mint a fizikai - kémiai rendszerek
Topic - 7: Solutions mind fizikai - kémiai rendszerekben. Telített és telítetlen megoldásokat. Az anyagok koncentrációjának az oldatban.
· Arrhenius elektrolitos disszociáció elméletének.
· A hidrolízis és sóelektrolízishez olvadékok és só megoldásokat.
· A felvétel egyenlet ioncserélő reakciók
· Határozzuk meg az oldat savasságát sav - bázis indikátorok.
· Olyan teljes körű és csökkentett ionos sók egyenlet hidrolízis.
· A terápiák a reakcióközeg sóoldatokban.
· A probléma megoldása érdekében a koncentráció megoldásokat.
7.1. Oldhatóság szerek.
Amikor vízben oldjuk, szilárd előbb bekövetkezik zúzás őket, hogy a molekulák vagy ionok majd diffúziója a részecskék az oldat térfogata.
A folyamat a feloldjuk a szilárd anyagot fel lehet gyorsítani, ha az őrlés, és kiderült egy por. A diffúziós végbemenő oldatot tipikusan gyorsítható keverjük az oldatot (ábra. 15). Ha az oldott fel egy víz felszínén, mivel az oldat nagy sűrűségű, akkor lefelé folyni az a tartály aljára, és a helyén lesz egy új rész vizet.
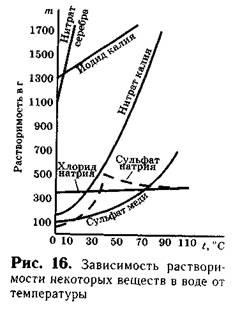
Köztudott, hogy az oldhatóság legtöbb anyag nem korlátlan. Tehát, normál körülmények között, 100 g vizet képes oldani körülbelül 36 g konyhasó, 40 g kálium-nitrátot, 200 g cukrot és hasonlókat. D. Ha vagyunk oldható, pl, 36 g nátrium-klorid 100 g vízben 20 ° C-on, majd a több sót ebben az oldatban nem oldódik.
Egy megoldás, amelyben az anyag egy bizonyos hőmérsékleten már nem oldódik, az úgynevezett telített. A fel nem oldódott só lesz az alján a hajó, amelynek a telített oldat.
Egy oldat, amelyben az anyag jobban oldódik egy adott hőmérsékleten, az úgynevezett telítetlen.
Súlya anyag egy telített oldat 100 gramm oldószerben egy adott hőmérsékleten, az úgynevezett az anyag oldhatóságát vagy oldhatósági hányados.
Ezek nagyban az anyag oldhatóságát. Oldhatóság az egyes anyagok nagyon kicsi. Így, az oldhatóság BaS04 Bárium-szulfát 100 g vízben egyenlő 0,00023 g ezüst-klorid és 0,00015 g ilyen anyagok azt mondják, hogy gyakorlatilag oldhatatlan. Ha az anyag oldhatósága nagyobb, mint 0,1 g, és kevesebb, mint 1 g 100 g vízben, valamit egy ilyen anyagot mondta, hogy kevés, vagy gyengén oldódik. Az ilyen anyagok közé tartozik a kalcium-szulfát CaS04, magnézium-foszfát Mg3 (P04) 2, és mások. A találmány szerinti vegyületek, amelyek oldhatósága nagyobb, mint 1 g 100 g vízben, tartják oldható. Így a oldhatósága nátrium-klorid 20 ° C-on - körülbelül 40, az oldhatóság kálium-jodid ugyanezen a hőmérsékleten egyenlő 144 g Ezek az anyagok oldódnak.
Amikor fűtött, a oldhatósága a legtöbb megoldás szilárd anyagban nő (ábra. 16).
A vízben oldható, és néhány folyadékok, mint például az alkohol, a glicerin. Egyéb folyadékok, mint például a benzin, olaj a vízben gyakorlatilag nem oldódik.
Gázok is vízben oldjuk. Az oldhatósági gázok vízben könnyen felismerni, ha öntjük egy pohár hideg vízzel kapcsolatos, és tedd meleg helyre. Egy bizonyos idő elteltével az üvegfalak a gázbuborékok.
Szénsavas víz - a szén-dioxid feloldódik a vízben. A gáz ilyen vízben oldjuk emelt nyomáson. Ezért, ellentétben a szilárd oldhatóságát a gázok növekvő hőmérséklettel csökken, és a nyomás növelésével - növekszik.
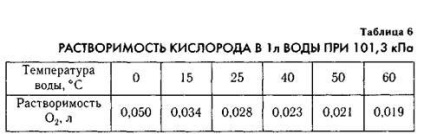
Nagy jelentősége van a oxigén oldódását a vízben, ez befolyásolja a fejlesztési és karbantartási az élet a vizekben.
Táblázat. 6, hogy a hideg víz oldott oxigén nagyobb. Ezért a hideg vizek az óceán víz alatti élet gazdagabb, mint a meleg víz. A hideg vízben a halak talált már. Ezért a fő kereskedelmi halászat területén található hideg vizekben.
1. anyagok, amelyek szilárd, folyékony vagy gáz-halmazállapotú, vízben oldjuk, amelyek oldat.
2. Növekvő hőmérséklettel oldhatóságának szilárd anyagok, általában megnövekedett, és a gáz - csökken.
7.2. Az oldatok koncentrációja
Egy fontos jellemzője az a koncentrációja, megoldásokat. By koncentráció aránya vagy mennyisége oldott anyag tömege a oldat térfogata. Jellemzően, az alkalmazott kémia moláris koncentrációt.
A moláris koncentrációja aránya nevű megoldás oldott anyag a az oldat térfogata:
CA = n__ (mol / l)
Ismerve a mennyiségét egy oldott anyag egy adott térfogatú oldat, lehetőség van, hogy meghatározzuk a moláris koncentrációját.
Így a koncentráció és a tömeghányada anyagot oldatban - különböző fogalom. Koncentráció jellemzi az oldatot, a tömeg frakció - oldott anyag.

2. Számítsuk ki a moláris koncentrációja az oldat, amelyben 300 ml oldatot 0,5 mol hatóanyagra vonatkoztatva.
3. az a moláris koncentrációja oldat 1,5 mol / l. Milyen mennyiségű oldott szereplő 200 ml oldatban?
4. Határozza meg a súlyát az anyag (M = 111 g / mol) tartalmazó 200 ml 0,5 M oldat.
* 5. Határozzuk meg a moláris koncentrációja 20% az anyag oldatát (M - 40 g / mol), sűrűsége p = 1,11 g / ml.
7.3. Egy elektrolitos disszociáció anyagok
A vizes oldatok, az egyes anyagok áramvezetésre. Meg tudjuk következtetni, hogy ez annak köszönhető, hogy néhány sajátossága a szerkezet?
Vegyük a három anyag - cukor, nátrium-klorid és a desztillált vizet. A telepítés ábrán látható. 17. ellenőrzés az elektromos vezetőképesség. Kísérletek azt mutatják, hogy ezek egyike sem anyagok nem elektromos áram vezetésére. Ezután előállítjuk a sót és a cukrot vízben, és meghatározza az elektromos vezetőképesség vizes oldatainak anyagok. A cukoroldatot nem folytat villamos áram és lebonyolítása sóoldat.
Hasonló kísérleteket, hogy meghatározzuk a villamos vezetőképesség a több anyagok, azok oldatai, valamint olvad lehetővé osztani az anyagot a két fő csoport - elektrolitok és nonelectrolytes.
Anyagok, oldatok vagy olvadékok, amelyek vezetik az elektromos áramot, az úgynevezett elektrolitok. Olyan anyagok, amelyek megolvad és megoldások nem vezeti az áramot nevezzük nemelektrolitok.
Azok a sók, alkáli- és sav - egy anyag ionos vagy poláros kovalens kötések. Nem-elektrolitok - cukor, alkohol, a nitrogén. oxigén és más anyagok, amelyek a nem-poláros vagy enyhén poláros kovalens kötés.
Ha egy megoldás egy anyag vezeti az elektromos áramot, amely eszköz a töltött részecskék, hogy lehet mozgatni az oldatban. Anélkül, hogy a e feltételek teljesülését az elektromos vezetőképesség nem lehetséges. Emlékezzünk: fémek vezetik az áramot is, mert vannak szabad elektronok őket.
Ionos vegyületek (sók, lúgok) állnak ionok, de nem vezeti a jelenlegi szilárd formában, mert ionok nem tud szabadon mozogni. Miért a töltött részecskék képesek mozogni az elektrolit megoldások? Talán az oka abban rejlik, hogy a vízmolekula-struktúra?
A atomok oxigén és hidrogén egy vízmolekula kötött poláris kovalens kötés, általában elektron párok felé tolódott elektronegatívabb oxigénatom. Ezért a parciális negatív töltés rajta kialakított (8), míg a hidrogénatomok - részleges pozitív töltést (# 948; +). Így a vízmolekula két pólusa, azaz a. E. Minden molekula dipólus.
A víz molekulák állandó hőmozgást, jelentős energia. Amikor vízbe merítjük ion a kristály nátrium-klorid, a vízmolekulák vonzódnak a pozitív végén a dipólusok negatív ionok és negatív - a pozitív ionok. A kinetikus energia a víz molekulák elegendő, hogy elpusztítsa a kristály sót egyes ionok és a Na Cl
A kapott nátrium-ionok és kloridionok vannak szabadon mozgatható
az oldatban, ezek hordozói töltés. Megsemmisítése sókristályok történik melegítve az olvadási hőmérsékletet. Így tehát az olvadék is megjelennek töltött részecskék, hogy szabadon tudjon mozogni.
Leegyszerűsíti a elektrolitos disszociáció felírható, mint egy egyenlet:
Az összes só disszociál fémionok és az ionok a sav rész, például:
Lúg disszociál fémionok és hidroxid-ionokat, például a
A töltések összege pozitív és negatív ionok előállításához elektrolitikus disszociáció anyag között azonos nagyságrendű.
Elektrolitikus disszociációja poláros anyagok kovalens kötés által a például sósav jelenlétében.
Amikor vízbe merítjük hidrogén-klorid poláris molekulái víz veszik körül a dipólusok. Hatása alatt a vízmolekulák kötést tartalmaz mindegyik molekula hidrogén-klorid még polarizált, a teljes elektronpár eltolódik teljes egészében egy klórt és a hidrogén ionok keletkeznek és klórt. disszociációs egyenlet anyagok poláros kovalens kötés van rögzítve, valamint anyagok ionos kötésekkel.
A tanulmány az anyagok tulajdonságai - az egyik legfontosabb módja, hogy tudjuk a szerkezetüket. Így a képessége egy anyag, hogy végezzen, vagy sem áramot vezessenek oldatok vagy olvadékok feltételezhetjük a természet a kémiai kötést tartalmaz. Az elektrolitok jellemző ionos vagy kovalens kötés erősen poláros. Process elektrolit ionok bomlásról elektrolitos disszociáció nevezik; ez a megoldás közötti kölcsönhatás miatt az anyag a dipólusok a víz és az olvadék - melegítéssel.
3. Írja elektrolitos disszociáció egyenlet a következő anyagok: a) KBr; b) NaF; a) Lil; g) HI.
4. írásához és olvasásához az egyenlet a elektrolitos disszociáció savak: a) HBr; b) H, S03; c) H3P04; g) NMp04.
5. ír és olvas a egyenlete elektrolitikus disszociációja lúgok: a) KOH: b) Ba (OH) 2; a) LiOH; g) Sr (OH) 2.
6. Gyártmány és olvassa egyenlet elektrolitikus disszociációja sók: a) MgCl2; b) Na3P04; a) CuS04; g) Fe (N03) 3.
7.4. tulajdonságok ionok
A tulajdonságait atomok és ionok azokból képződött azért különbözőek, mert azok eltérő szerkezetű. Ahhoz hogy ezt úgy atomok és nátrium- és klorid-ion.
Ionok által alkotott kiigazítás a elektronhéjak nátrium és klóratom. Elektronikus nátriumion burkolat hasonló köpeny neon atom, kloridion - a
elektron héj argon atom (ábra. 22). Ezért a tulajdonságait a nátrium-ionok és kloridionok vannak egészen más, mint a nátrium- és klóratom. Fémnátriumot atomokból áll, és a nátrium-ionok, és a klórgáz - a molekulák, amelyek mindegyike a két klóratomot. Ismeretes, hogy a nátrium - aktív fém és a klór - aktív nonmetal. Ezek a vegyületek jelentős mértékben eltérnek a nátrium-klorid (konyhasó), amely a nátrium-ionok és a klorid ionok. Így, nanatriya kloridot és kloridionokat. Így, nátrium-klorid ellentétben klórt színtelen, szagtalan és a nem-mérgező. Eltérően a nátrium-klorid nem reagál a vízzel, és a vízből hidrogén nem szorít. Ha fém-nátriumot és a klórgáz káros az emberi test, az ionok Na + és Cl szükségesek a normális életre. Ezért, a konyhasó adnak az élelmiszerekhez.
nátrium-ionok és kloridionokat egy színtelen oldatot. Vannak azonban olyan színű ionok. Így, egy olyan oldatban, Cu2 + ionok egy kék szín és savas ionok permangánsav maradékot MnO4- - málna-ibolya. (A káliumsó e sav - a kálium-permanganát KMn04 széles körben használják a gyógyászatban, mint „permangánsav” A kálium-permanganát oldattal színezett miatt Mn04-ion.).
Anyagok tartalmazó színes ionokat lehet használni annak bizonyítására, hogy az ionok - töltéssel rendelkező részecskék. Végezzük ezt az élményt. Nedvesítse be a szűrőpapírt oldattal kálium-nitrát, amelyről ismert, hogy áramot. Csatlakoztassa a nedvesített szűrőpapír oldattal egy elektrolitot, hogy a DC-forrás és helyezze a kristályok réz-klorid (II) SuS12 (ábra. 23). A rézionok színű, és a kálium-ionok,-klorid - és nitrát ionokat színtelenek. Egy idő után a sókristályok a negatív töltésű elektród lapok húzta festett. Ennélfogva, Cu rézionokat elmozdulni a negatív elektród - katód. képes
Azt feltételezzük, hogy ebben az azonos irányban, és mozgassa a kálium ionok K és a klorid ionok Cl - és nitrát ionokat NO3- mozgatjuk felé a pozitív töltésű elektród - az anód.
Ionok mozog az elektromos mezőben a katód, nevezzük kationok.
Az ionok mozognak az elektromos mező az anód, az úgynevezett anionok.
Anionjai hidroxid ion OH, és az ionok anionok N03-, SO42-, Cl -, stb ..
Mint láttuk, az ionok - töltött részecskék, és ezért kölcsönhatásba keresztül Coulomb erők. Köszönhetően ezek az erők az ionokra oldatban lehet mozgatni hatása alatt állandó elektromos áram. Most emlékezni, hogy a víz molekulák dipólusok (lásd. Ábra. 18), vagyis a pozitív és negatív töltések a molekulában és a vizet elválasztjuk annak különböző részein. Ezért, az ionok reakcióba léphetnek ezeket a díjakat és olyan vegyületeket kapunk.
A folyamat kialakulásának a vegyület ionok vízmolekulák nevezzük hidratálást. Alakult ebben a kérdésben, az úgynevezett hidrátok.
A szilárd kristályos hidrátok során képződött lassú víz elpárolgását oldatok nevezett kristályos hidrátok.
Kristályos hidrátjait általában egy állandó struktúra. Azaz a kristályos - bluestone - tartja öt molekulák CuS04-5H20 vizet. Példák egyéb kristályos: FeS04-7H20; Na2CO3-10H2O.
A hidratációs folyamat miatt előfordul, hogy a mozgása ionokat és poláris molekulákat a víz. Az erők tartja a részecskék egymáshoz közel vannak, és elektromosan.
A folyamat a hidratációs összehasonlítható a kialakulását ionos kötésekkel, szilárdsági vízvisszatartást molekulákat és ionokat, - Coulomb. Ezért hidratálásra energia kiválasztása következik be. Az oldatot fel kell fűteni. Valóban, feloldjuk a savak, lúgok, és néhány só-ra melegítjük, érzékelhetően. Így, hő szabadul fel úgy, hogy az oldat forrni feloldásával kénsavat. Ezért biztonsági szempontból hígításával tömény kénsavat túlfeszültség következik be kis részletekben vizet. A sűrűsége a kénsav nagyobb, mint a vízé, így lesz aljára az edény. Így fűtés a megoldás kerül fel egyenletesen és nem forraljuk.
Együtt hidratáció, amikor oldott anyagok a vízben kerül sor, mint ismeretes, a diffúzió és fragmentáció a szemcsés anyag az egész oldat térfogata. Amikor az áramlás ezek a folyamatok az oldatot le kell hűteni, mert a munkájukat végzik zúzás kristályok formájában. Vannak olyan anyagok, mint például nitrátok, amely, ha vízben oldjuk, az oldat hőmérsékletét csökkentjük jelentősen. Összefoglalás termikus hatás oldó anyagok mennyiségétől függ a felszabaduló energia hidratációs és elnyelt energia hasítás. Ha a hidratációs szabadul megelőzte a ráfordított csiszolás az anyag, akkor a megoldás melegítjük. Ezzel szemben, ha a töredezettség fordított energia az anyag nagyobb, mint ez megjelent a hidratálás, az oldatot lehűtjük.
1. Tulajdonságok atomok és ionok lényegesen különböznek. Ez annak köszönhető, hogy a különbség a szerkezet a saját elektron kagyló és a jelenléte a díjak a ionok.
2. Az ionok, hogy térvezérlésű DC vándorolnak a katód, az úgynevezett kationok, és az, hogy mozgassa az anódhoz, - anionok.
3. A folyamat során a kioldódási, és amellett, aprítás anyagot diffúzióval történik, mint hidratációs, azaz a kölcsönhatás poláris molekulái víz ionok. Ennek eredményeként ez a folyamat termelt hidrátok.
4. Szilárd hidrátok vízmolekulákat tartalmazó saját kristályok, úgynevezett kristály hidrátok.
5. A hőhatás oldódás anyagok függ energiát fordítunk a zúzás az anyag és energia szabadul miatt hidratálást.