ionos kötéssel
Egy atom, van két fő lehetőség tárgya semmilyen jobb lu oktett. Az első közülük - a kialakulását ionos kötést. (Második - az oktatás, a kovalens kötés azt az alábbiakban tárgyaljuk.). A formáció a ion-hidrogénklorid kapcsolatot fématom veszít elektronokat és válik a nem-fématomhoz. Vegyük például az elektronikus szerkezetét a nátrium és klóratomok:
Na 1s 2s 2 2 2p 6 3s 1 - egy elektron külsőleg
Cl 1s 2s 2 2 2 2p 6 3s 3P 5 - hét elektronok külsőleg
Ha a nátrium-atom továbbítja egyetlen elektron Zs klóratom, oktett szabály teljesül a két atom. Lesz nyolc klór atomot elektronok a külső harmadik réteg, míg a nátrium atomok - szintén nyolc elektronok a második réteg, amely mára a külső:
Cl - 1s 2s 2 2 2 2p 6 3s 3P 6 - nyolc elektronok külsőleg
ionos kötés kialakítása
A rendszermag nátrium-atom még mindig tartalmaz 11 protonok, de a teljes elektronok száma csökken a 10. Ez azt jelenti, hogy a szám a pozitív töltésű részecskék egyik nagyobb, mint a több negatív töltésű, ezért a teljes nátrium-töltés „atom” +1.
„Atom” klór őt tartalmaz 17 protont és 18 elektronok és díj -1.
Töltésű atomok által alkotott elvesztése vagy megszerzése egy vagy több elektront nevezik ionok. A pozitív töltésű ionok nevezzük kationok. és a negatív töltésű anionok nevezzük.
Kationok és anionok, melynek ellentétes töltések vonzzák egymást elektrosztatikus erők. Ez a vonzás ellentétes töltésű ionok nevezzük ionos kötést. Ez felmerül a vegyületek, melyekben a fém és egy vagy több nemfémek. A következő vegyületeket megfelel ezeknek a kritériumoknak, és egy ionos jellegű: MgCl2. Fel2, CUF, Na2 0, Na2 S04. Zn (C2 H3 02) 2.
Van egy másik módja, hogy a képeket az ionos vegyületek:
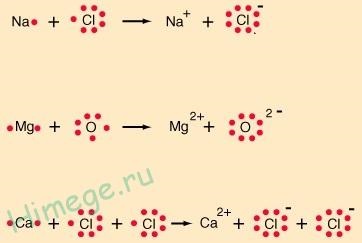
Ezekben a képletekben, pontokat mutatják, csak az elektronok a külső héj (vegyérték elektronok). Ezek a képletek nevezzük Lewis után a képletek AME Rican kémikus G. N. Lewis, az egyik alapító (együtt L. Pauling) kémiai kötés elmélet.
A elektronok átvitelét az fématomhoz kapcsolódik, és egy nemfémes-oktatása ionok lehetséges köszönhetően annak a ténynek, hogy a nem-fémek nagymértékben elektronegativitása, és fémek - alacsony.
Mivel az erős vonzereje ionok egymáshoz ionos vegyületek többnyire a szilárd és viszonylag magas az olvadáspontja.
Ionos kötéssel van kialakítva a elektronok átvitelét egy atom NE tallium nonmetal atom. A kapott ionok Péld-Giwa össze elektrosztatikus erők.