A transzmembrán jelátvitel
transzmembránjel
Fontos tulajdonsága a membránok - képes fogadni és továbbítani a jeleket a sejtbe a külső környezettől. „Tanulás” jelző molekulák révén ágyazott a sejtmembránban a célsejtek, vagy a sejt receptor fehérjék. Célsejtet képességük alapján határoztuk meg, hogy szelektíven kötődik egy adott jelátviteli molekulához receptor.
Ha a jel által érzékelt membránreceptorok, az adatátviteli áramkör az alábbi képlettel ábrázolható:
receptor kölcsönhatás jelző molekulával (az elsődleges mediátora);
Aktiválása membrán enzim felelős a kialakulását a második hírvivő;
képződését második messenger cAMP, cGMP, IP3, DAG, vagy Ca2 +;
aktiválását közvetítik specifikus fehérjék, főként protein kinázok, amelyek viszont, foszforiláló enzimekkel, amelyek befolyásolják aktivitását az intracelluláris folyamatokat.
Annak ellenére, hogy a hatalmas különböző jelátviteli molekulák, receptorok és eljárások hogy ezek szabályozzák, kevés a megfelelő mechanizmus a transzmembrán információ továbbítása: az adenilát-cikláz rendszert, inozitolfosfatnoy rendszert, katalitikus receptorok, citoplazmatikus vagy nukleáris receptor.
Szignál molekulák - hormonok, neurotranszmitterek, növekedési faktorok, NO
Jelátviteli molekulák lehetnek nem-poláros és poláros anyagok. Nem-poláros anyagok, mint a szteroid hormonok, belépnek a sejtbe, áthalad a lipid kettősréteg. Polar jelző molekula egy sejt nem tud behatolni, de köti specifikus sejtmembrán receptorokhoz. Az ilyen kölcsönhatás okozza a lánc események maga a membrán, és a sejten belül. A poláris jelátviteli molekulák közé tartoznak protein hormonok (glukagon, az inzulin), neurotranszmitterek (acetilkolin, glicin, γ-amino-vajsav), növekedési faktorok.
Lokalizáció megkülönböztetni hártyaszerű, citoplazmatikus és nukleáris receptorok. A találmány egy másik osztályozás, az összes receptor lehet osztani bystrootvechayuschie (belül ezredmásodperc) és medlennootvechayuschie, néhány percen belül, vagy akár órákig, ami jellemző a hormon adási jelet intracelluláris receptorokhoz. Receptorok az első típusú - integrált oligomer fehérjéket tartalmazó alegység, amelynek van egy agya kapcsolására egy jel molekula és központi ioncsatorna.
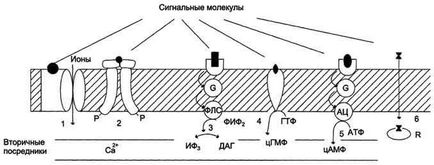
Receptorok részt vesznek a transzmembrán jelátvitelt.
Receptorok: 1 - kapcsolódó ioncsatornák, például a GABA-receptor; 2 - A katalitikus aktivitással (inzulin receptor); 3 - egy jel adására a foszfolipáz C, például α1 adrenoceptor; 4 - A katalitikus aktivitással (guanilát cikláz receptor PNF- pitvari natriuretikus faktor); 5 - egy jel adására az adenilát-ciklázhoz, például β-adrenerg receptorok; 6 - hormon kötő a citoszolban, vagy sejtmagban, így például kortizol receptor.
Receptorok a második típusú. lokalizálódik a membránokat, és nem kapcsolódik a csatornák vannak osztva két nagy csoportra: katalitikus receptorok, amely tirozin-kináz-saját vagy a guanilát-cikláz aktivitását és a receptorok kölcsönhatásba keresztül a G-fehérje membrán enzimet. A ligandum kötődése (például hormon) receptort a külső a sejtmembrán vezető aktivitás változása a citoplazmatikus enzim, ami viszont kiváltja a celluláris választ, azaz Információ kerül továbbításra a membránon keresztül, és nem oldott vagy felelős a molekula.
Abban az esetben, a citoplazmatikus membrán receptorokhoz áthalad hormon, és információkat a jelenléte a hormon a cellában keresztül receptor át a sejtmagba.
Különböző sejtek a test, attól függően, hogy azok funkcióit egy bizonyos sor receptorok. A membrán az egyik cella lehet több, mint egy tucat különböző típusú receptorok. Kölcsönhatásban áll a receptor extracelluláris kémiai hírvivők anyagcseréjét befolyásolják, és a funkcionális állapot (proliferáció, szekréció, stb) célsejteket.
A kölcsönhatás a hormonok receptorokkal konjugált G-fehérje aktiválódásához vezet az adenilát-ciklázt vagy inozitolfosfatnoy szabályozási rendszerek.
Részvételével adenilátcikiáz bevezetett rendszer több száz különböző hatások jellegétől jelző molekulák - hormonok és neurotranszmitterek.
Üzemeltetése transzmembrán jelzési rendszerek öt fehérjében.
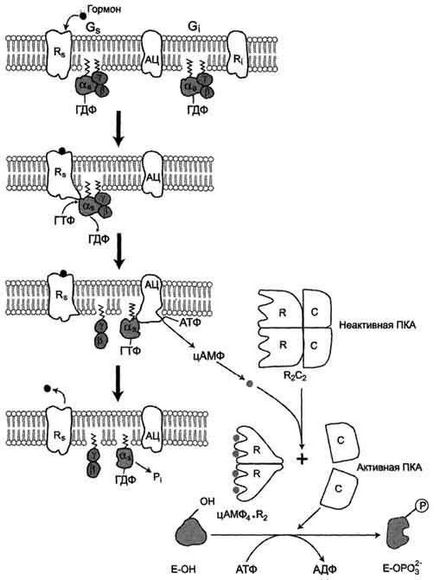
Integrált membránproteinek citoplazmatikus: Rs-receptor aktivátora adenilát-cikláz rendszert és Ri receptor inhibitora adenilát cikláz rendszer
„Zayakorennyve fehérjék»: Gs -GTF kötő fehérje tartalmaz aS. β, y és alegységei Gj -GTF kötő fehérje tartalmaz αi. β, γ-alegységből és egy sejten belül működő enzim protein kináz A (PKA).
A szekvenciát a vezető események adenilát-cikláz aktiválását:
Két receptorkötő hely: hormon külső felületén a membrán és a G-fehérje a belső felületén a membrán.
Kölcsönhatás adeniiil rendszer, például hormon receptor (Rs), változáshoz vezet a receptor konformáció
Fokozott affinitás a receptor Gs -fehérje. Komplexet képez, hormon-receptor.
Csatlakozási hormon-receptor komplex a Gs -GDF csökkenti az affinitást a α-alegységének Gs -fehérje a GDF és növeli a affinitása a GTP. Az aktív központjában aS alegység GDP helyébe GTP;
Ez változást hoz létre a konformációban aS alegység és csökkentett az affinitása az a βγ-alegységek
Szegregált aS -GTF alegység oldalirányban mozog a lipid réteg a membrán közepén a kötődését az adenilát-cikiáz enzim
Kölcsönhatás aS - GTP-alegységnek adenilát cikláz változást okoz a konformációjában az enzim aktiválását, és növeli a sebességét cAMP képződését ATP;
A cellában, növeli a koncentrációt cAMP - második messenger hormon jel
CAMP molekula reverzibilisen kapcsolódni a regulátor alegységek a protein kináz A, amely két szabályozási és két katalitikus alegységet
Joining cAMP szabályozó alegységéhez disszociációját okozza a komplex, katalitikus alegység elválasztjuk és aktívvá válik
Aktív protein kináz A ATP felhasználásával foszforilálja specifikus
fehérjék szerin és treonin, ennek eredményeként a változó a konformációját és aktivitását
foszforilált fehérjék, és ez vezet a változás sebessége és iránya
a szabályozási folyamatok a sejtben.
Menetes mechanizmus erősítés és elnyomására. Jel átvitelét a membrán receptor G-protein az adenilát-cikiáz enzim példaként szolgál kaszkád rendszer erősítés ezt a jelet. Egy molekula, amely aktiválja a receptor, lehet „tartalmaznak” több G-fehérjék, és akkor minden néhány molekula aktiválja az adenilát-ciklázt, hogy készítsen ezer molekulák cAMP. Ebben a szakaszban, a jelet felerősítve, hogy február 10-március 10-szor. Alakult cAMP „tartalmaznak” egy másik enzim - a protein kináz A, jel erősítésére a még 1000-szer. A foszforilezést protein-kináz-enzimeket egy további felerősíti a jelet, ami a teljes erősítés június 10-július 10-szer. Így, a mechanizmus a amplifikációs kaszkád egy molekula szabályozó, amely képes megváltoztatni aktivitását millió más molekulák.
Inozitolfosfatnaya rendszer tartalmaz 3 membrán fehérjék:
R- receptor aktivátor rendszer inozitolfosfatnoy - integráns fehérje
A foszfolipáz C - felszíni fehérje
Gplc - GTP-kötő fehérje aktiválja a foszfolipáz C - rögzítő fehérje
nyújt a rendszer működését kalmodulin fehérje, a protein kináz C enzimet, állítható membrán Ca 2+ csatornák EPR, Ca 2+ -ATPáz celluláris és mitokondriális membránokon
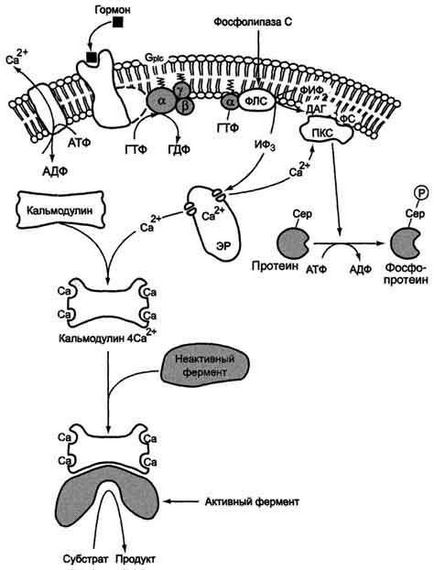
A szekvenciát a vezető események a foszfolipáz C aktiválását:
kötődését egy jelátvivő molekula, mint például a hormon receptor (R), ami egy konformációs változás és fokozott affinitás Gr1s proteinek,.
képződését hormon-receptor komplex Grls -GDF csökkenti az affinitást αrls -protomera Grls -fehérje a GDF és a fokozott affinitást GTP. Az aktív helyén GDF αrls alegység helyébe GTP.
Ez változást hoz létre a konformációban αrls alegység, és ez elkülönül a βγ-
az elválasztott α- alegység GTP oldalirányban elmozdul, a membránon keresztül, hogy a központ a kötődését az enzim foszfolipáz C
reakciójával α- alegység GTP fosfoliggazoy C változás konformációját és aktivitását az enzim növeli a hidrolízis sebességét a foszfolipid sejtmembrán foszfatidilinozitol 4,5-biszfoszfát (FIF2).
a hidrolízis és van kialakítva a citoszolba a hidrofil anyagot inozit-1,4,5-trifoszfát (IP3). Egy másik reakció terméket a diacilglicerin (DAG), a membránon belül marad, és részt vesz az enzim aktiválását a protein kináz C (PKC).
inozit-1,4,5-trifoszfát (IP3) hozzákapcsolódik a specifikus központok Ca 2+ csatorna ER membrán, ez vezet a változás a fehérje konformációjára és a nyitó Ca 2+ csatorna. Ca 2+ koncentráció gradiens belép a citoszolba. Hiányában IP3 a citoszolban zárt csatornán.
Aktiválódását a protein-kináz C
Növelése Ca 2+ koncentráció a a sejtek citoszoljába növeli a kölcsönhatásának sebességére Ca 2+ egy inaktív citoszol protein kináz C enzimet (PKC) és a fehérje kalmodulin.
Kötő protein kináz C kalciumionokkal lehetővé teszi az enzim, hogy csatlakozzon a kalcium-közvetített kölcsönhatás molekulák „sav” membrán foszfolipid, foszfatidil-szerin (PS). Diacilglicerin, figyelembe specifikus központok a protein-kináz C, még inkább fokozza affinitását kalciumionok.
A belső oldalán a membrán által képzett enzimes komplex - (Ca 2+ PKC ▪ ▪ ▪ DAG FS) - egy aktív protein-kináz C foszforiláció specifikus enzimek által szerin és treonin.
Részvétel fehérje kalmodulin jelátviteli inozitolfosfatnoy
A sok szövet sejtjeinek kalmodulin fehérje jelen van, amely úgy működik, mint egy intracelluláris Ca 2+ receptor. van egy 4 pont Ca 2+ kötődését. Koncentrációjának növelésével a kalcium kalmodulin-ben csatlakozik, olyan komplexet képez (4SA -kalmodulin 2+), és ez a komplex kölcsönhatásba lép különféle fehérjék és enzimek, amely az aktiválódásukhoz sebességét növeljük a foszforiláció szerin és treonin.
Mivel a legtöbb rendszer a transzmembrán jelzési inozitolfosfatnaya rendszer nemcsak áttételi mechanizmus, de a mechanizmus elnyomására. Citoszoljában jelenlévő az inozit-1,4,5-trifoszfát (IP3) és diacil-glicerinné (DAG) a membrán vezethet egy sor reakciót ismét átalakíthatjuk foszfatidilinozitol 4,5-biszfoszfát (FIF2). Az enzimek, amelyek katalizálják a foszfolipid helyreállítási, aktiválják foszforiláció protein kináz C
A koncentráció a Ca 2+ a sejtben csökken az eredeti szintre hatására Ca 2+ -ATP-áz citoplazma membránon és az ER, valamint Na + / Ca 2+ -és H + / Ca 2+ -translokaz (aktív antiport) sejt és a mitokondriális membránok .
Működés transzlokáz Ca 2+ és Ca 2+ ATP-áz lehet aktiválni:
komplex (4SA -kalmodulin 2+);
A protein-kináz (foszforiláció);
protein kináz C (foszforiláció). Koncentrációjának csökkentésére Ca 2+ a sejtben, és diacil-glicerin, egy membrán változást okoz konformációjában protein kináz C, csökkentve annak affinitása a foszfatidilszerin, az enzim disszociál a citoszolba (inaktív forma). A foszforilált protein kináz C enzimek és fehérjék alatt fosfoproteinfosfatazy bejut defoszforilezett forma.
Receptorok guanilát-cikláz aktivitását
Guanilát-cikláz képződését katalizálja cGMP a GTP, az egyik fontos mediátorai az intracelluláris jelátvitelt.
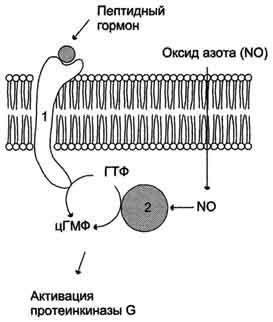
Aktivitásának szabályozási a membrán (1) és a citoszolikus (2) guanilát-cikláz.
Guanilát-cikláz van a sejtben, a membrán-kötött és a citoszol. Az arányokat a két forma az enzim különböző szövetekben eltérő. Például, a sejteket a vékonybél 90% guanilát-cikláz membránokban, és a tüdőben és a májban - csak 20%. Citoszol és a membrán-asszociált guanilát különböznek nem csak a lokalizáció, hanem molekulatömeg, aktivitás, szabályozási eljárást.
A citoszol guanilát-cikláz formájában két alegységből áll (α és β), és tartalmazza az összetételében prosztetikus csoportot - hem. A területen a aktivátor kötődik a hem a guanilát-cikláz az ebben a formában - a nitrogén-oxid (NO), amely képződik az arginin, az enzim által a nitrogén-oxid-szintáz.
Membrán-asszociált guanilát cikláz - transzmembrán glikoprotein. Az intracelluláris domén guanilát-cikláz katalitikus hatást, az extracelluláris domén a receptor használjuk. Joining aktivátor receptor konformációs változást okoz a membránban, és citoszolikus domain és ennek következtében, a aktiválását guanilát-cikláz. Az emberi szövetekben 3 típusú membránhoz kapcsolódó guanilát cikláz aktiváló amelyek specifikus vezérlők - atriális nátriuretikus faktor (PNF), agyi nátriuretikus peptid és intesztinális peptid guanilin.
A sejtek szövetek kiderült, három fő típusa az intracelluláris receptor fehérjék, amelyek kölcsönhatásba lépnek a cGMP: cGMP-függő protein-kináz (protein kináz G), a cGMP-szabályozott ioncsatornák és cGMP-szabályozott foszfodiészteráz, cAMP-specifikus (katalizálja a cAMP AMP).
cGMP fontos szerepet játszik a szabályozás Ca 2+ -gomeostaza különböző sejttípusok. Megnövekedett cGMP koncentráció csökkenéséhez vezet a Ca 2+ koncentráció eredményeként aktiválása Ca 2+ -ATP-ázt, és a miatt a elnyomása receptor-felvételi az iont a sejt citoplazmájába. Ezek a hatások által közvetített protein kináz G membránfehérjék metabolizmusában résztvevő Ca 2+.
Jelátvitel intracelluláris receptorok
Jelátvitel lipid-oldható szteroid hormonok és a tiroxin csak akkor lehetséges, áthaladása során ezek a hormonok plazmamembránján keresztül a célsejtek.
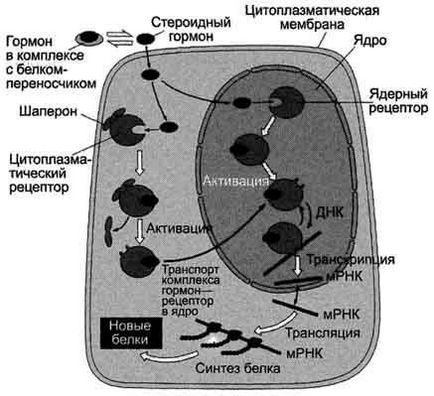
Átviteli jel intracelluláris receptorok.
hormon receptorok lehetnek a citoszolban vagy a sejtmagban. A citoszol-receptorok társul a protein-chaperon, amely megakadályozza az idő előtti aktiválását a receptor. Nukleáris és citoszol szteroid receptorokat és a tiroid hormonok tartalmaznak DNS-kötő domént, amely kölcsönhatások a sejtmagban a hormon-receptor komplex szabályozó DNS-helyek.
A szekvenciát a vezető események a specifikus fehérjék expresszióját:
hormon áthalad a lipid kettősréteg a sejtmembrán, és kölcsönhatásba lépnek a receptorral.
hormon-receptor komplex bejut a sejtmagba, hogy kölcsönhatásba lép egy szabályozó nukleotidszekvencia DNS - enhancer vagy hangtompító.
növekszik (reagáltatva enhancer) vagy csökkenti (reagáltatva hangtompítók) hozzáférhetőségét a promoter az RNS-polimeráz.
-kal megnövekedett vagy csökkent transzkripciójának sebességét strukturális gének.
érett mRNS-nek a magból
növeli vagy csökkenti fordítás sebességét.
számának változtatásával a fehérjék, amelyek hatással lehetnek a metabolizmus és a funkcionális állapotát a sejt.
A hormonok hatásait, amelyek átvitt jel útján intracelluláris receptorok nem figyelhető meg közvetlenül, mert az áramlási mátrix folyamatok (transzkripció és transzláció) időt vesz igénybe.
A kutatók számára a relatív száma jeltovábbító molekulák, receptorok a relatív mennyisége transzmembrán jelzőrendszerek, szekunder mediátorok titok marad, mint protein-kináz van kiválasztva megfelelő enzimet útvonala foszforiláció. A kutatók ezt a jelenséget, amely „a hipotézist a cél.” E hipotézis, a specificitását a protein kinázok és fosfoproteinfosfataz kialakítása útján érhető el rekeszek a membránon, amelyek közé nem csak az a protein-kináz és a fosfoproteinfosfatazy, hanem a specifikus fehérje szubsztrátok. Szabad maradékot mirisztinsav vagy palmitinsav a szerkezet a fehérje-szubsztrát - feltétele a „horgonyzó” a megfelelő membrán rekeszbe.
Azonban, a legtöbb esetben, a folyamat aktiválását metabolikus folyamat szabályozása alatt nem egy, hanem több intracelluláris jelátviteli rendszerek, így fontos tényező a sejt-válasz a kapcsolat e rendszerek.