Triple Point - studopediya
Vesszük az anyag folyékony formában, és található annak telített gőz egyensúlyi állapotban, és anélkül, hogy megváltoztatná a hangerő vált elvenni hőt. Ezt a folyamatot kíséri a külső hőmérséklet csökkenése egy anyag és egy megfelelő csökkenését nyomás. Ezért, a lényeg képviselő halmazállapot a diagramon (p, T), lefelé mozog a párolgás görbe (ábra. 47a). Ez addig folytatódik, amíg az ideig, amíg egy kristályosodási hőmérséklete az anyag, megfelelő egyensúlyi nyomás értékét. Jelöljük ezen a hőmérsékleten Ttr. Minden alkalommal megy kristályosodási folyamat, a hőmérséklet és a nyomás változatlan marad. Alatt visszavont Ez a hő a felszabadult hőtől kristályosítás során.
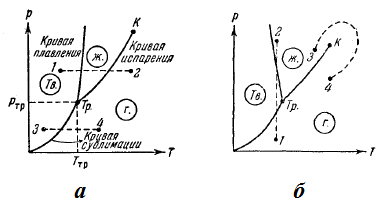
Ábra. 47. ábrái
A hőmérséklet TTR-nek és a megfelelő egyensúlyi nyomás PTR - csak a hőmérséklet és a nyomás, amelynél egyensúlyban lehet három fázisban az anyag: szilárd, folyékony és gáz halmazállapotú. A megfelelő pont a diagramon (p, T) van az említett hármas pont. Így, a hármas pont meghatározza a feltételeket, amelyek egyensúlyban lehet egyidejűleg a három fázis az anyag.
Végén a kristályosítási folyamat egyensúlyi lesz szilárd és gáznemű fázisok. Ha továbbra is, hogy a hőt az anyag, a tem-mérséklet csökkenni kezd újra. Ennek megfelelően, gőznyomása kisebb, a kristályos fázis egyensúlyban van. A lényeg mutató halmazállapot lefelé mozdul a szublimációs görbe.
A hőmérséklet a hármas pont az a hőmérséklet, amelynél az anyag megolvad, miközben a nyomás alatt egyenlő ptr. Más nyomás, az olvadási hőmérséklet eltérő lesz. A kapcsolat a nyomás és hőmérséklet által képviselt olvadási, az olvadási görbe, kezdve a hármas pontban. Így, a hármas pont fekszik a kereszteződésekben a három görbe, meghatározó egyensúlyi állapotok a két fázis, szilárd és folyékony, folyékony és gáznemű, és végül a szilárd és a gáznemű.
Attól függően, hogy a kapcsolat a specifikus térfogatú szilárd és folyékony fázist az olvadási görbe akár ábrán. 47a. vagy mint ábra. 47b.
Olvadási görbe, a párolgás és a szublimáció koordinátarendszerben van osztva három területen. A bal oldalon a szublimáció és olvadási görbe fekszik a régióban a szilárd fázis, a görbék közötti, és az olvadó párolgási terület zárt folyadék állapotok, és végül, hogy a jobb oldalán a görbék párolgás és szublimáció régió kiterjeszti gáznemű Államok az anyag. Minden pont egy ilyen terület jelentése megfelelő egyfázisú halmazállapot (minden alkalommal van szem előtt csak az egyensúlyi állapot, azaz a. E., ilyen állapotban, amelyben számít, mint hosszabb tartózkodás állandó külső feltételek). Minden pont fekvő, amelynek célja a régió határoló egyik görbén mutatja az egyensúlyi állapot megfelel a két fázis az anyag. A hármas pont jelenti egyensúlyi állapotát három fázis.
Így minden pont a grafikon egy bizonyos egyensúlyi állapot az anyag. Ezért nevezzük fázisdiagrammjának.
A fázisdiagram, amelynek alapja a kísérleti adatok, lehetővé teszik, hogy megítélni a feltétellel az adott anyag bizonyos p és T, valamint hogy milyen fázisátalakulások fog bekövetkezni egy adott folyamat. Például, olyan körülmények között, megfelelő 1. pont (. Ábra 47a), az anyag szilárd állapotban, 2 - a gáz, és bármely pontján az olvadási görbe - mind folyékony, mind szilárd állapotok. Tegyük fel, hogy az anyag szilárd állapotban pontnak megfelelő 1, megy keresztül izobár melegítés, ábrázolt fázisdiagram a vízszintes szaggatott vonal 1 -2. Az ábra azt mutatja, hogy a megfelelő hőmérséklet a kereszteződésekben a szaggatott vonal a olvadási görbe, az anyag megolvad magasabb hőmérsékleten metszéspontjának megfelelő 1-2 egyenes bepárlással görbe kezd alakulni gáz. Ha az anyag szilárd állapotban megfelelő 3 pont, a kristály válik egy gáz anélkül, hogy a folyékony fázis alatt izobár melegítés (szaggatott vonal 3-4). Ha a állapotdiagram van az ábrán bemutatott formában. 47b. az izotermikus kompresszió a 1 állapot az állami 2 a gázfázisból anyaga el fog haladni a szilárd, majd a folyékony.
Bepárlás görbe végződik a kritikus pont K. Ezért, folyamatos átmenet lehetséges a folyékony anyagot gáz halmazállapotú, és vissza a kritikus pont. keresztezése nélkül a párolgás görbe (átmenet 3-4 ábrán. 47b), t. e. átmeneti, hogy nem kíséri fázisátalakulások. Ez azért lehetséges, mert a különbség a gáz és a folyadék egy tisztán mennyiségi (mindkét állapotok, például olyan izotróp). Az átmenet a kristályos állapotú (jellemezve anizotrópia) folyékony vagy gáz csak hirtelen (eredményeként fázisátalakulás), így olvadási és szublimációs görbe nem lehet folytonos, mint ahogy az a párolgási görbét a kritikus pont. Olvadási görbe végtelenhez tart, és a görbe egy szublimációs pont, ahol p = 0 és T = 0.