Raoult törvénye - studopediya
A folyadékok oldódik egymásban minden arányban, a törvény a Raul. Jelző telített oldószer gőznyomása tiszta oldószer keresztül 0. p és az oldat feletti - P, az arány (P 0 - P) / P 0 lesz az úgynevezett relatív csökkenése gőznyomás az oldat felett. A különbség (p 0 - p) = Ap úgynevezett abszolút csökkenése gőznyomást. Raoult törvénye matematikai kifejezés egy egyenlet (F 0 - F) / F 0 = X, ahol X - móltörtje oldott anyag.
Így, Raoult törvénye azt jelzi, hogy a relatív csökkenése a telített oldószer gőznyomása az oldat feletti egyenlő a móltörtje oldott anyag.
Amikor a szilárd oldatok a nem illó anyagok illékony oldószerek, a parciális nyomások az oldott anyagok elhanyagolt. Raoult-törvény érvényes, nem elektrolit oldatok a nagyon alacsony vagy magas koncentrációja az egyik komponens. A közbenső koncentrációk megoldások tulajdonságok eltérnek az ideális, jelezve, hogy van egy közötti kölcsönhatás az oldószer és az oldott anyag.
Gőznyomásának csökkentésére az oldat feletti befolyásolja a fagyasztás és forráspontja megoldásokat. Mivel a móltörtje között az oldott anyag és a gőz nyomása közvetlen kapcsolat áll fenn az oldat felett, egyértelmű, hogy a hatás az oldott anyagoknak a forráspontja, és a fagyasztás oldatot is kapcsolódik a koncentrációjával.
Feltárása a fagyasztás és forralás megoldások, Raul létrehozta a következő jogszabályok:
1) növelik a forráspontja az oldat arányában móljainak a száma az oldott anyag, feltéve, hogy a mólszáma az oldószert folyamatosan:
ahol E - ebulioskopicheskaya konstans, amelynek nagysága egy határozott értéket minden oldószert és nem függ a jellege az oldott anyag; Cl - molal az anyag koncentrációja. A fizikai jelentése ebulioskopicheskoy állandók az, hogy amikor Cl = 1, ez odnomolyalnogo növeli a forráspontja a megoldás, mivel ebben az esetben δtkip = E
2) csökkenti a fagyáspontot az oldat arányában móljainak a száma az oldott anyag állandó mennyiségű oldószert:
ahol K - oszmométerek állandó, amelynek értéke nem függ a jellegétől az oldott anyag és csak attól függ, az oldószer jellegétől.
Így, néhány fizikai tulajdonságainak a híg oldatok (gőznyomás az oldat felett, a forráspont és fagyasztás céljaira) a koncentrációtól függ, és nem függ a jellege az oldott anyag az oldatban. Ezért ezeket a tulajdonságokat nevezzük kolligativ (a latin. Colligatus_sobirat).
Amikor tanulmányozása tulajdonságait megoldások széles körben használják -membrany féligáteresztő partíció, a jellemzője, amely a képességük, hogy adja át a molekulák az oldószer, de megtartják az oldott anyag szemcséinek. (Ábra. 3).
A jelenséget a anyagátadási oldószer egy féligáteresztő membránon keresztül, amelyen keresztül a kis molekulák tud megszökni, de nem képes az elhaladó nagy molekulák a hígított oldatot egy oldat nagyobb koncentrációban, az úgynevezett ozmózis.
A nyomás, hogy kell létrehozni, amelynek egyik oldala a membrán, ahol az oldat, hogy függessze ozmózis nevezzük ozmotikus nyomás. Tanulmányozzák az ozmózis engedélyezve van't Hoff származhat egy egyenletet, amely azt mutatja, hogyan függ a ozmózisnyomás (nem elektrolit oldatok) koncentráció: ozmotikus nyomás egyenlő a nyomás, amely előállított lenne oldott anyag, ha ez a formája az ideális gáz veszi az azonos mennyiségű ugyanezen a hőmérsékleten :
ahol π - ozmotikus nyomás, Pa; C - a koncentráció mol / l; R az egyetemes gázállandó; T - abszolút hőmérséklet.
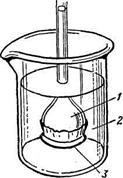

3. ábra. Berendezés bemutatási ozmózis 1 - oldatot; 2 - az oldószert; 3 - féligáteresztő membrán
Moláris az oldat koncentrációját úgy határozzuk meg, a képlet
ahol m - oldott anyag tömege; M - moláris anyag tömege; V - az oldat térfogata. Behelyettesítve ezt a kifejezést az egyenlet van't Hoff, megkapjuk
Leírunk kolligatív tulajdonságok (forráspont hőmérséklet-emelkedés oldatok, csökkenti a fagyasztási hőmérséklet, ozmotikus nyomás) vannak végtelenül híg oldatban a nem-elektrolitok.
Bevezetés a megoldás az elektrolitok (sók, savak és bázisok) is hatással lesz a kolligatív tulajdonságok, de ebben az esetben vannak bizonyos sajátosságok jellegével kapcsolatos az elektrolitok magukat. Így, ha a vízben oldódni 1 mol NaCl, a kapott molekula iont bomlási megjelenni az oldatban 2 mól ionok (Na + 1 mol 1 mol és C1), és minden egyes ilyen ionok kifejtheti hatását a független megoldás. Várható, hogy a vizes nátrium-klorid (és hasonló molekulák) kolligatív tulajdonságok jelennek meg kétszer erősebb, mint, például egy cukrot vizes oldat. Ezt támasztja kísérletileg. Így csökkenti a fagyasztási hőmérséklet tartalmazó oldat 1 g nátrium-klorid 100 g vizet, csaknem kétszer δtzam. számítják Raoult törvénye.
Rendellenes vegyületek hatásait ion kolligatív tulajdonságok egyre kifejezettebb nagy ionos töltések. Ahhoz, hogy az utolsó egyenlet került alkalmazásra, hogy meghatározza az ozmotikus nyomás az oldat, van't Hoff vezetünk a reaktorba korrekciós együttható I (izotóniás koefficiens), amely lényegében azt jelzi, a tényleges száma, ionos vagy molekuláris kialakítva egy mól oldott anyag. Ezért, az egyenlet válik P = 1000i (m / MV) RT
Sok biológiai folyamatok a növényi és állati szervezetek, társított ozmózis jelenléte miatt bennük az úgynevezett biológiai membránok. sejtfal membránok, amelyek a vízzel szemben áteresztők, nem telt el a feloldott anyagok intracelluláris folyadék. A belső környezet a sejt eltér a külső viszkozitás, kémiai összetétel, ion tartalom, és így tovább. D. A külső membrán korlátozza a belső környezet a külső és fenntartja ezeket a különbségeket az egész élet a cella. Megváltoztatása a kémiai összetétele a körülvevő környezet a sejt vezet változást ozmózisnyomást, mint társított fontos biológiai folyamatok, mint például turgor. plazmalizálódnak és hemolízis.
Nem tudja pumpálni a vizet vagy nasasyvayut közvetlenül, sejtek szabályozzák beáramlás és kiáramlás a víz, koncentrációjának változtatásával az oldott anyagok a bennük tartalmazott. Ahhoz, hogy több vizet abszorbeálnak, a sejt elnyeli több különböző sók, glükóz, oldható molekulák vagy egyéb vegyületek. Ennek eredményeként a növekedése sejtkoncentráció oldott részecskék. Víz törvényei szerint ozmózis elkezd folyni a sejtbe, és megpróbálta kiegyenlíteni saját koncentráció mindkét oldalán a membrán.

Mivel a rendszer működik, amíg az oldott anyag koncentrációját a sejten kívül, és a sejtben közelítőleg egyenlő. Ha a közeg az oldott anyag koncentrációja magasabb, mint magát a sejtet, vagy ha a közeg sejtek lényegében száraz levegő, a sejt vizet veszít, zsugorodik, mint ez történik, amikor a növények elhervadnak száraz forró napon. Vízzel kiáramlása cella tartalmát tömörített és eltér a sejtfal (ábra. 1).
Ábra. 1. turgorát és hervadás növények.
A. Növényi sejteket körül egy híg oldattal, felszívja a vizet ozmózissal a sejtmembránon keresztül, és továbbra is duzzadásáért. B. Növényi sejteket körül egy koncentrált oldatot, vizet veszítenek miatt ozmózis és növényi elszáradt.
Ha azonban a növény elszáradt vízbe tesszük, a víz visszakerül a cellába. Válnak feszes, azaz megduzzad víz és ismét megnyomja a sejtfalak, benyújtása turgornyomás irányított belülről kifelé. A sejtfalak lehet feszített csak egy bizonyos határig, ami után kezdődik, hogy az ellennyomás, kiszorítja a vizet a sejtekből azonos ütemben, amellyel belép az ott. Ezen a módon, a sejt fal védi a sejt: nem adnak nekik, hogy tört nyomása alatt a felesleges vizet.
Sok állati sejtek helyezi őket tiszta vízzel, vagy nagyon híg oldatban, tört, mert nem rendelkezik a sejtfalak (ábra. 2).
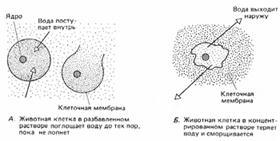
Ábra. 2. ozmózis állati sejtekben.