A képlet a nátrium-propionát in Chemistry
Meghatározás és nátrium-propionát képletű
Nátrium-propionát - egy komplex szerves vegyület osztályába tartozó karbonsav-só.
Normális körülmények között, a kristály szerkezet egy szilárd (monoklin kristály rendszer) fehér színű (ábra. 1). Nedvszívó. Igen jól oldódik vízben. Forms kristályos hidrátok készítmény C2 H5 COONa × H2 O.

Ábra. 1. Nátrium-propionát. Megjelenés.
A kémiai képlete nátrium-propionát
A kémiai képlete nátrium-propionát felírható különböző módon: C2 H5 COONa, CH3 CH2 COONa vagy C3 H5 O2 Na. Ez azt mutatja, hogy a szerkezet ezen molekula három szénatomot tartalmaz (Ar = 12 amu), öt hidrogénatom (Ar = 1 amu), egy nátrium-atom (Ar = 23a.e.m .) és a két oxigénatom (Ar = 16 amu). Szerint a kémiai képlet alapján számítható molekulatömegű nátrium-propionát:
Úr (C2 H5 COONa) = 3 × Ar (C) + 5 × Ar (H) + Ar (Na) + 2 × Ar (G);
Úr (C2 H5 COONa) = 3 × 12 × 5 + 1 + 23 + 2 × 16 = 36 + 5 + 23 + 32 = 96.
Grafikus (szerkezeti) általános képletű nátrium-propionát
Structure (grafika), a képlet inkább intuitív, ez tükrözi az atomok kapcsolódnak a molekulán belül a nátrium-propionát (ábra. 2).
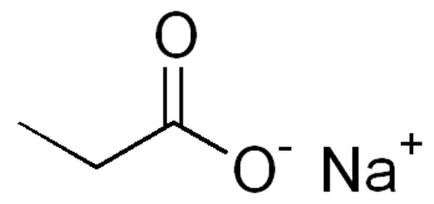
Ábra. 2. Grafikus képletű nátrium-propionát.
ionos képletű
Nátrium-propionát - gyenge elektrolit. A vizes oldatot, az elektromos áram részlegesen disszociál ionokra szerint a következő egyenlet:
Példák problémák megoldása
Az égési keverék, amely két térfogatnyi ismeretlen gáz és oxigén térfogat felére, alakított keverékét egy térfogat nitrogénatomot és három térfogatrész vizet gőz. Minden esetben, a gáz térfogatát lemértük, azonos körülmények között. Mi az a képlet az ismeretlen gáz?
Mivel a molekuláris nitrogén (N2) és víz (H2 O) égése során az ismeretlen gáz oxigén, a gáz összetétele áll nitrogén, hidrogén és esetleg oxigént. Jelöljük az atomok száma az egyes említett kémiai elemek, mint „x”, „y” és a «z». Ekkor a képlet egy ismeretlen gáz általában nem kerül rögzítésre a Nx Hy Oz.
A törvény szerint a kötet kapcsolat, gáz mennyiségének arányos a számos anyagot, és az együtthatók a reakció egyenlet. Ezzel write reakcióegyenlet ismeretlen gáz elégetése oxigén általános formában:
A törvény szerint a tömegmegmaradás anyagok az atomok számát minden egyes eleme a bal és jobb oldalán az egyenlet egyaránt olyan
2 = 2; Itt x = 1;
Következésképpen, általános képletű ismeretlen NH3-gázt. Ez az ammónia.
Kimeneti képletű kristályos cink-foszfát, ha ismert, hogy a tömeghányada só ez 84,2%.
Tegyük fel, hogy egy sablonos a kristályos egység magában foglalja az n vízmolekulák, vagyis általános képletű kristályos Zn 3 (PO 4) 2 × NH2 O.
Számítsuk ki a molekulatömege a vízmentes só:
Úr (Zn 3 (PO 4) 2) = 3 × 65 + 2 × 31 + 8 × 16 = 195 + 62 + 128 = 385.
Ismeretes, hogy M = úr, azt jelenti, M (Zn 3 (PO 4) 2) = 385 g / mol. Találunk moltömegére kristályos:
Számítsuk ki a vízmolekulák száma (moláris tömege víz 18 g / mol):
Ezért, a képlet a kristályos cink-foszfát formájában van Zn 3 (PO 4) 2 × 4H2 O.