Kén-oxid (VI) és a kénsav, felkészülés qm és CSE Kémia
Színtelen, olajos folyadék illékony, t ° op. = 17 ° C; t ° fűtött. = 66 ° C; levegőn „dohányzik” erősen szívja a nedvességet (tárolt lezárt edényekben).
SO 3 igen jól oldódik 100% -os kénsavat, az oldatot nevezzük óleum.
1) A kén-dioxid - savas-oxid.
Vízzel való kölcsönhatás
Amikor vízben oldjuk, ez ad egy erős kétbázisú kénsav:
Disszociáció megy végbe lépéseket:
H 2SO 4 → H + + HSO 4 - (első szakasz van kialakítva hidrogénszulfát - ion)
HSO 4 - → H + + SO 4 2- (második lépés kialakítva szulfát - ion)
H 2SO 4 formájában, két sorban sók - átlagos (szulfátok) és savas (hidrogén-szulfátok)
Kölcsönhatás lúgok
NaOH + SO 3 (feleslegben) → NaHSO 4
Kölcsönhatás az alap-oxidok
Fizikai tulajdonságai kénsav:
A nehéz olajos folyadék ( „olaj vitriol”);
sűrűsége 1,84 g / cm3; nem illó, vízben jól oldódik - egy erős hő; t ° op. = 10,3 ° C, t ° fűtött. = 296 ° C, nagyon higroszkópos, azt dehidratáló tulajdonságai (szenesedés papír, fa, cukor).
A hidratációs hő olyan nagy, hogy a keverék forraljuk, permetezzük és égési sérülést okozhat. Ezért szükséges, hogy a savat a vízhez, de nem fordítva, mert a víz hozzáadásával savas víz könnyebb lenne a sav felületen, ahol a hangsúly az összes felszabadult hőt.
Az ipari termelés kénsav (kapcsolati módszer):
Zúzott tisztított nedves pirit (pirit) felülről öntenek a kemence a „fluid ágy”. Bottom (ellenáramú elv) áthaladó levegő, oxigénben dúsított.
A kemence kilép kemence gáz, amelynek az összetétele: SO2. O2. vízgőz (pirit nedves volt), és a finom részecskék kalcinált (vas-oxid). A gáz tisztított részecskék a szilárd szennyezők (a ciklon és az elektrosztatikus) és vízgőz (egy szárító toronyban).
A kapcsolati berendezés kén-dioxid oxidáljuk egy olyan katalizátor alkalmazásával V 2O 5 (vanádium-pentoxid), hogy növelje a reakció sebességét. A oxidációja egy oxidot a másik reverzibilis. Ezért, az optimális körülményeket választunk közvetlen reakció áramlás - nagynyomású (mivel a közvetlen reakció a csökkentése, a teljes térfogat), és a hőmérséklet nem haladja 500 C (mivel a reakció exoterm).
Az abszorpciós toronyban történik felszívódását kén-oxid (VI) tömény kénsavval.
vízfelvétel nem használják, mert a kén-oxid feloldódik a vízben, hogy kiadja nagy mennyiségű hőt, így a képződő kénsavas forrni kezd, és gőzzé alakul át. Annak elkerülése érdekében, képző kénsavgőz használt -ing 98% -os tömény kénsavat. Kén-oxid nagyon oldható ilyen sav formában óleum: H2 SO4 · nSO3
Kémiai tulajdonságait kénsav:
H2 SO4 - erős kétbázisú sav, az egyik legerősebb ásványi savak, köszönhetően a magas polaritású kötés H - O könnyen leszakadnak.
1) Egy vizes kénsav-oldattal disszociál. amely egy hidrogénion és savmaradék:
H2 SO4 = H + + HSO4 -;
HSO4 - = H + + SO4 2.
Az általános egyenlet:
H2 SO4 = 2H + + SO4 2.
2) A reakciót kénsav fémekkel:
Hígított kénsavat csak akkor oldódik fémek állt az elektrokémiai sorozat maradt hidrogén:
Zn 0 + H2 +1 SO4 (híg) → Zn2 + SO4 + H2
5) A kicserélési reakciót a sók:
BaCl2 + H2 SO4 → BaSO4 ↓ + 2 HCI
A formáció fehér BaSO4 csapadék (savban oldhatatlan) kimutatására használt kénsav és oldható szulfátok (kvalitatív reakció szulfát-iont).
A különleges tulajdonságokat tömény H 2SO 4:
1) tömény kénsavat erős oxidálószer; reagáltatva fémekkel (kivéve Au, Pt), hogy visszakapjuk S +4 O2. S 0 vagy H2 S -2 függően a fém aktivitását. Anélkül, fűtés nem reagál Fe, Al, Cr - passziválás. Amikor kölcsönhatásban fémeket változó vegyértékű utóbbit oxidálva van a magasabb oxidációs állapotú. mint a helyzet a híg savas oldat: Fe 0 → Fe 3+. 0 Cr → Cr 3+. 0 Mn 4+ → Mn, Sn → Sn 4+ 0
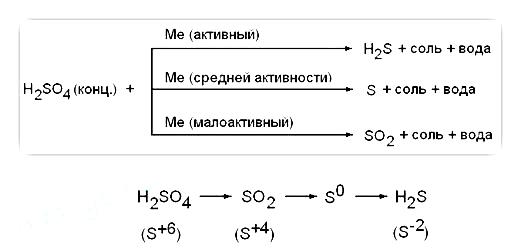
Metal közepesen aktív
2) Koncentrált kénsavat oxidálja néhány nem-fémek hajlamosak, hogy maximalizálja az oxidációs maga visszanyeri dos + 4O2:
3) Oxidáció komplex anyagok:
A kénsav oxidálja a HBr és HJ a szabad halogének:
KBr 2 + 2H2 SO4 = K2 SO4 + SO2 + Br2 + 2H2 O
2 KI + 2H2 SO4 = K2 SO4 + SO2 + I2 + 2H2 O
Tömény kénsavat nem oxidálni kloridion, hogy klórmentes, amely lehetővé teszi a sósav képződésének a kicserélési reakció:
NaCl + H2 SO4 (konc.) HCI + = NaNSO4
Kénsav elfogyasztó kémiailag kötött víz a szerves hidroxilcsoportokat tartalmazó vegyületek. Kiszáradás etanol jelenlétében tömény kénsav vezet előállítására etilén:
C2 H5 OH = C2 H4 + H2 O.
. Cementálás cukor, cellulóz, keményítő és más szénhidrátok érintkező kénsavval is köszönhető, hogy a kiszáradás:
C6 H12 O6 + 12H2 SO4 = 18H2 O + 12SO2 ↑ + 6CO2 ↑.