A természet a kémiai kötés a komplex vegyületek
Komplex vegyületek olyan vegyületek, amelyek léteznek a kristályos állapotban, mind oldatban, ami a jellemzője, hogy központi atom körül ligandumok. Komplex vegyületek lehet tekinteni, mint egy magasabb sorrendű komplex vegyületek, amelyek egyszerű molekulák, önmagában is előforduló az oldatban.
Koordinációs elmélete Werner egy példát:
A külső és a belső szférában
Ezen elmélet szerint, a központi atom vagy ion. a legtöbb esetben formájában kationok (általában pozitív töltésű), a koordináták (azaz, szoros) maga körül számos anionok vagy molekulák, amelyek az úgynevezett ligandum. (Vagy ligandumok - a régi neve). Egyszerű pozitív töltésű kation a ligandumok nem hatnak.
A központi atom (komplexképző szer)
A komplex képződését ion vagy semleges komplex lehet elképzelni, mint egy általános típusú reverzibilis reakció:
ahol M - semleges atom, pozitív vagy negatív töltésű ion feltételes kombinálásával (koordináló) önmaga köré más atomok, ionok vagy molekulák L. atom M nevezik, vagy komplexképző központi atom.
A komplex ionok [Cu (NH3) 4] 2+. [SiF6] 2-. [Fe (CN) 6] 4-. [BF4] - komplexképző hatóanyagok a réz (II), szilícium (IV), vas (II), bór (III). A legtöbb kelátképző szolgál atomja pozitív oxidációs állapotú.
Függő negatív ionok (azaz atomok negatív oxidációs állapotban) játszanak szerepet a komplexképző viszonylag ritkák. Ez, például, nitrogénatom (III) ammónium-kation [NH4] +, stb
Atom-komplexképző szer lehet egy nulla oxidációs állapotú. Így,-karbonil komplexek a nikkel és a vas, amelynek az összetétele a [Ni (CO) 4] és [Fe (CO) 5], tartalmazhat atomok nikkel (0) és a vas (0).
Komplexképző (félkövér) lehet a reakciókban részt termelő komplex mint egy egyértékű-ion, például:
és hogy egy része a molekula:
Az összetett részecskék lehetnek két vagy több komplexképző atom. Ebben az esetben beszélünk többmagos komplexek.
Komplex tartalmazhat több komplex ionok, amelyek mindegyike tartalmaz egy komplexképző szer.
Például egy egymagos komplex vegyület összetétele [K (H2 O) 6] [Al (H2 O) 6] (SO4) 2 komplexképző K (I) és Al (III), és a [Cu (NH3) 4] [PtCl6] - Cu (II) és Pt (IV).
A komplex ion, vagy semleges komplexek koordinált körül komplexképző ionok, atomok vagy egyszerű molekulák (L). Mindezek a részecskék kémiai kötéseket a komplexképző szert, az úgynevezett ligandumok (a latin «ligare» - nyakkendő). A komplex ionok [SnCl6] 2- és [Fe (CN) 6] 4- ligandumok ionok Cl - és CN -. neutrális komplex [Cr (NH3) 3 (NCS) 3] iigandumok - NH3 molekulák és ionok NCS -.
A ligandumok általában nem kapcsolódnak egymással, és a taszító erő hat közöttük. Egyes esetekben, van intermolekuláris kölcsönhatása ligandumok a hidrogén kötések kialakulását.
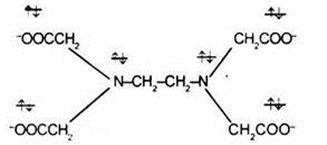
A ligandumok lehetnek különböző szerves és szervetlen ionok és molekulák. A fő ligandumok ionok CN -. F -. Cl -. Br -. I -. OH -. SO3 S2 -. C2 O4 2-. CO3 2-. molekulák H2 O, NH3. CO, karbamid (NH 2) 2 CO, szerves vegyületek - etilén-diamin-NH2 CH2 CH2 NH2. # 945; -aminouksusnoy NH2 CH2 COOH sav és etilén-diamin-tetraecetsav (EDTA):
Leggyakrabban, a ligandum kapcsolódik a komplexképző szer révén egyik atom egy két központ kémiai kötés. Ez a fajta ligandumok nevezzük fogú. Között egyfogú ligandumok közé tartoznak a halogén-ion, cianid-ion, ammónium-hidroxid, víz és mások.
Néhány gyakori típusú ligandumok vízmolekulák H2 O, hidroxidion OH -. tiocianátiont NCS -. amid-ion NH2 -. CO szénmonoxid előnyösen egyfogú komplexek, bár egyes esetekben (a hídszerkezetek) vannak kétfogú.
Számos ligandumok, amelyek komplexek szinte mindig kétkötőhelyű. Ez etiléndiamin, karbonát ion, oxalát ion, stb Mindegyik molekula vagy ion alkotnak egy kétfogú ligandum komplexképző két kémiai kötéssel összhangban a jellemzői a szerkezete:
Például, a komplex [Co (NH3) 4 CO3] NO3 kétfogú ligandum - ion CO3 2- két kötést képez a komplexképző szert - feltételes ion Co (III), és az egyes NH3 ligand-molekula - csak egy kötést:
Egy példa a hatfogú ligandum anion szolgálhat etilén-diamin-:
Többfogú ligandumok hathatnak áthidaló ligandumok, amelyek egyesítik a két vagy több, a központi atom.
A ligandumok száma körülvevő központi ion az úgynevezett koordinációs száma (CN). A koordinációs szám lehet értéke 2; 3; 4; 5; 6, stb legfeljebb 12 (például, néhány vegyület ritka földfémek). A leggyakoribb koordinációs száma 2; 4; 6. A koordinációs szám magasabb, mint 8 ritkábbak.
Az érték CZK komplexképző szer számos tényezőtől függ:
- a természet a ligandum és az elektronikus tulajdonságait;
de általában kétszer a díjat a ion komplexképző szer.
Az értékek között koordinációs szám és az oxidációs-komplexképző elem van egy határozott kapcsolatot. Így a komplexképző elemek, amelyek oxidációs számú +1 (Ag 1. Cu 1. Au 1. I 1 és mtsai.), A legjellemzőbb koordinációs száma 2 - például a komplexek a típus [Ag (NH3) 2] +. [Cu (CN) 2] -. [IBr2] -.
Elements-komplexképző oxidációs állapotban +2 (Zn 2. Pt 2. Pd 2. Cu 2 stb) gyakran képeznek komplexeket, amelyek azt mutatják, amelynek koordinációs száma 4, mint például a [Zn (NH 3) 4] 2+. [PtCl4] 2 -. [Pd (NH3) 2Cl2] 0. [ZnI4] 2 -. [Cu (NH3) 4] 2+.
A koordinációs száma a komplexképző aqua komplexeket az oxidációs állapot + II gyakran 6: [Fe (H2 O) 6] 2+. [Mg (H2 O) 6] 2+. [Ni (H2 O) 6] 2+.
Elements-komplexképző szerek, amelyek oxidációs számú +3 és +4 (Pt Al 3. 4. 3. Co Kr Fe 3. 3) vannak komplexek, általában QP = 6.
Például, [Co (NH3) 6] 3+. [Cr (OH) 6] 3-. [PtCl6] 2-. [AlF6] 3-. [Fe (CN) 6] 3-.
Ismert komplexképző szerek, amelyek lényegében állandó koordinációs számok komplexek különböző típusú. Ezek a kobalt (III), króm (III) vagy platina (IV) QP = 6 és a bór (III), platina (II), palládium (II), arany (III) QP = 4. Ennek ellenére a legtöbb komplexképző változtatható koordinációs száma. Például az alumínium (III) lehetségesek QP = QP = 4 és 6 a komplexek [Al (OH) 4] -, és [Al (H2 O) 2 (OH) 4] -.
A koordinációs számok 3, 5, 7, 8 és 9 viszonylag ritkák. Vannak csak néhány a vegyületek, amelyekben CN 12 - mint például K9 [Bi (NCS) 12].
Együtt a központi atom koordinált ligandum alkotnak belső koordinációs (azaz, komplex) szférában. hogy írásakor a képlet szögletes zárójelek között. A fennmaradó ionok nem marad a belső gömb, a távolban a központi ion, alkotó külső koordinációs szférában. Képviselete a komplex képletű vegyület, egy külső-iont szögletes zárójelben.
Például, a vegyületek a [Cu (NH3) 4] (OH) 2, és a K2 [HgI4] külső-ionok rendre ionok OH - és K +. A semleges komplexei [Cr (NH3) 3 (NCS) 3] 0 és [Pd (NH3) 2Cl 2] 0 nincs külső szférában.
Jellemzően, a külső gömb képeznek egyszerű egyértékű vagy többértékű ionok. Vannak azonban olyan esetek, amikor egy komplex vegyület, amely két vagy több belső területein feladatokat ellátó kationos és anionos részeit a vegyület. Itt minden a belső gömb külső tekintetében a többi.
Például, a vegyületek a [Cu (NH3) 4] [PtCl6] és [Ni (NH3) 6] 2 [Fe (CN) 6] formálisan funkciót végezhet külső-ionok:
- komplex anionok [PtCl6] 2- és [Fe (CN) 6] 4-.
Komplex vegyületek, amelyek a külső gömb erős elektrolitok, és disszociál vizes oldatok szinte teljes egészében a komplex ion, és az ionok a külső gömb. Amikor kicserélődési reakciók, komplex ionok át egyik a más vegyületek összetételének megváltoztatása nélkül.
A hazai szférában Us komplexképző ligandum donor-akceptor eredete és jelentése kovalens kötés. A szerepét egy elektron akceptor végez komplexképző amelynek szabad pályák és kielégítően magas pozitív töltésének a sejtmagban, és úgy járnak, mint a donor ligandumok képesek a komplexképző reagens, így egy nem megosztott elektronpárt. Ionok jelen a külső gömb, társított komplex ionok főleg elektrostaticheskogogo kölcsönhatás.
Meghatározása töltés (z) magszemcsék a komplex vegyület egy példát: K [Al (OH) 4].
A felelős belső gömb a komplex vegyület egyenlő az algebrai összege díjak és a komplexképző ligandumok:
Ezzel szemben, ismerve a töltés a komplex ion, és a töltés a ligandumok [Al (OH) 4] -) meg tudja határozni az oxidáció mértékét komplexképző: x + (-1) × 4 = -1; X = 3. Az oxidáció mértéke a +3 alumínium.
A felelős belső gömb az ionok kompenzálja a külső gömb a komplex vegyület. A példában, a belső koordinációs szféra [Al (OH) 4] -. A felelős az anion ebben az esetben kompenzált kation K +. található a külső koordinációs szférában.
A ligandumok szolgálnak molekulák vagy ionok tartalmazó donor atomot (a leggyakoribb N, P, O, halogének), egy kelátképző képes, amely egy nem megosztott elektronpárt.
A helyek száma által tartott minden egyes ligandum belső terén a komplex vegyület, az úgynevezett koordinációs kapacitással (gyrus) ligandum. Ez határozza meg a számát elektron pár a ligandum, részt vesz a kialakulását egy koordinációs kötést a központi atom.
Szerint a száma kötéseket a komplexképző ligandum. ligandumok vannak osztva mono-, di- és többfogú ::
1. tartalmazzák fogú anionok F -. Cl -. Br -. I -. H -. CN -. NO -. SCN - stb semleges molekulák (NH3 aminok, például primer RNH2 (R -. szerves gyök), vízmolekulák, stb), amelynek csak egy donor atom.
2. A kétfogú ligandumok olyan molekulák vagy ionok két funkcionális csoportot tartalmazó képes adományozni elektron pár két. Például,
A molekula etilén-diamin-oxálsav-dianion
3. többfogú ligandumok közé tartozik a 6-többfogú ligandum tetraanion etilendiamintriuksusnoy-tetraecetsav (EDTA):