Előállítására szolgáló módszerek a legfontosabb dién
Előállítási módszerei szénhidrogének száma divinil a legtöbb esetben nem különböznek a módszerek előállítására olefinek egyetlen releváns reakciót kell végezni kétszer, vagy kiindulási anyagként használható vegyület már egy kettős kötést tartalmazó.
Butadién és izoprén iparilag dehidrogénezésével rendre bután-butilén vagy izo-izoamilenovyh általában keverékek tartalmazó katalizátorok Cr2 O3:
2. Egy nagyon fontos szerepet játszik az ipari termelés butadién játszott eljárás SV Lebedev:
3. Divinil, izoprén, diizopropenil vízelvonással állítjuk elő, glikolok:
4. Hlorpren hozzáadásával nyert hidrogén-kloridot adva vinilatsetilenu:
Fizikai tulajdonságai 1,3-alkadiének
Divinil normál körülmények között - gáz. Izoprén és más egyszerű alkadiéneket - folyadék. Hagyományos minták rejlő homológ sor szénhidrogének, és ebben a sorozatban.
A alkadiének konjugált kettőskötést jellemzi kórosan magas törésmutatójú. Ennek köszönhetően a funkció eredménye molekuláris fénytörés jóval alkadiéneket számított. A különbség a számított és talált értékek általában 1 ÷ 1,5 egység. Úgy hívják molekuláris túlfűtöttség.
Kémiai tulajdonságait 1,3-alkadiének
Két konjugált π-kötések alkotják a teljes elektron felhő - négy szénatomot tartalmazó vannak sp 2 hibridizációs (lásd 2. fejezet). Ez lerövidíti egyszeres kötés (a 0,146 nm) és stabilizálják a molekulát. Például, a képződési energiája divinil molekula 14,6 kJ / mol magasabb, mint a számított energia a formáció szénhidrogén ugyanolyan összetételű, de kizárva a konjugáció a kettős kötések. Ez a különbség az úgynevezett rezonancia energia. Ez a funkció a szerkezet a dién szénhidrogén teszi őket kapcsolni képes különböző anyagok nem csak az egyik kettős kötést, hanem a szélsőséges atomok a konjugált rendszer - a 1,4-helyzetben a mozgás a kettős kötés. Az ilyen csatlakozás által meghatározott dinamikus hatását konjugáció, azaz újraelosztása az elektronsűrűség a molekula hatása alatt egy támadó szer.
A katalitikusan gerjesztett hidrogén asztalosok, 1,2- és 1,4-pozíciók:
A halogének is képes csatlakozni a párosodási rendszer az 1,2- és 1,4-helyzetben:
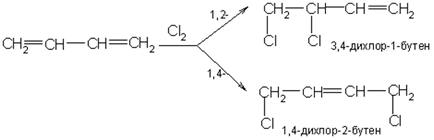
Mint abban az esetben az etilén szénhidrogének, a csatlakoztatás végbemehet mind ionos és gyökös mechanizmus.
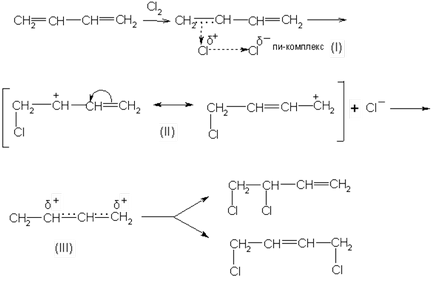
Amikor egy ionos mechanizmus mellékletet eredetileg előforduló π-komplexet (I) gyorsan átalakul a konjugátum karbóniumiont, amelynek pozitív töltést a második és a negyedik szénatom. Ez az ion leírható két vagy határoló (II), vagy egy (III) képletű. Ez szénkation tulajdonít halogén anion termékeket képeznek, 1,2- és 1,4-addíció:
A reakciókat a hidrogén-halogenidek kapcsolat, ugyanazt a mintát:
Hipohalogenittel savak és ezek észterei előnyösen kapcsolódnak a 1,2-helyzetben:
Amikor fűtött, a molekulák dién szénhidrogén képes csatlakozni össze oly módon, hogy egyikük reagáltatunk 1,2- és 1,4-helyzetben, a másik. Ezzel egyidejűleg, kis mennyiségű termék képződik, amikor a két molekula reagálnak 1,4-helyzetben:
Dién szénhidrogének különösen dimert könnyen a molekulák, amelyek aktivált kettős kötést. Az ilyen típusú reakciók nevezik dién szintézissel vagy Diels-Alder-reakció:
Fontos jellemzője Diének konjugált kötések képesek polimerizáljuk gumiszerű termék.
Ipari szempontból az a láncpolimerizációja dién szénhidrogének hatása alatt katalizátorok vagy iniciátorok. Ahogy alkalmazott katalizátorok alkálifémek, fémorganikus vegyületek, mint iniciátor - szerves és szervetlen peroxidok.
A polimerizációs az egyedi monomerek molekulák egymáshoz az 1,2-, 1,4-helyzetben vagy egy molekula reagáltatjuk 1,2-, és más - a 1,4-helyzetben:
A polimerizáció sebessége függ a szerkezet a diének és a polimerizációs körülmények között. A szubsztituensek a közepén a molekula könnyebb, és a végén a molekula akadályozza polimerizációt. Az izoprén polimerizálódik gyorsabb és piperilén lassabb, mint a butadién.
A legértékesebb termék előállítható sztereospecifikus (térben rendezett) polimerizációs 1,4-helyzetben, hogy egy cisz-konfigurációban minden egyes maradék:
A kémiai összetétele és szerkezete a természetes gumi cisz sztereoreguláris polimerek izoprén.
A szerkezet a gumi és más polimerek, dién szénhidrogének bizonyította ozonizálása (a Garriesu). Előállítás ozonolízis a levulinsav aldehid megerősíti 1,4-rendezett szerkezet.
Különböző típusú szintetikus és természetes kaucsuk széles körben használják az iparban. Az úttörő szerepet a szervezet a nagyüzemi termelés szintetikus gumi volt a Szovjetunióban.
FELADATAI SELF
1. Számítsuk ki a tömege (g) 1,3-butadién előállított eredményeként dehidrogénezésével bután 20 dm 3 (n. Y.) Ha butadién hozam 50%.
2. Amikor elhaladnak a 200 dm 3 (a n. Y.) etil-alkohol gőz fölött vízelvonó katalizátor és dehidratálószer 90 dm 3 kaptunk GAS (AT-n. Y.) butadiént. Határozzuk meg a reakció hozamát.
3. Számítsuk ki a legnagyobb tömeg (g) brómot, amely csatlakozhat a 1,3-butadién, ha ez a mennyiség a 12 dm 3 (normál körülmények között).
4. Az oxidációs a telítetlen szénhidrogén kapjuk Garriesu acetonnal végezzük, amelynek tömege azonos volt a 29. meghatározott tömege (g) a telítetlen szénhidrogén, az el nem reagált, azon a feltételezésen alapul, hogy a hozam ozonolízis terméket - kvantitatív.
5. Név a szénhidrogén szerint a nemzetközi nómenklatúra
6. Írja szerkezeti képlete: 2,5-dimetil-4-izopropil-1,5-hexadién.
3.4. Az alkinilcsoport: meghatározása, izoméria, nómenklatúra
Alkinek nevezett szénhidrogének mellett # 963; -kötéseken két π-kötés (hármas kötés) van egy pár szénatomot tartalmaznak. Az általános képlet a homológ sorozat acetilén-szénhidrogéneket CnH2n-2. Az őse ez a sorozat az acetilén.
Izomériát és szakkifejezések
Acetilén-szénhidrogének IUPAC nevezett, ugyanazt a szabályt, mint abban az esetben, telített szénhidrogének, de az utótag „en” helyébe a utótag „yn”. A fő áramkör választjuk meg, hogy elérje a hármas kötést, és van számozva a végén, ahol szorosabb hármas kötést.
A legegyszerűbb acetilénes szénhidrogének gyakran nevezik alkil-szubsztituált acetilén, azaz racionális nómenklatúra:
Izoméria acetilén szénhidrogének úgy definiáljuk, mint a szerkezet a szénváz és helyzete a hármas kötés.
Acetilén-szénhidrogéneket kapunk, akár úgy alkilezésével az acetilén, vagy hasításával hidrogén-halogenid vagy halogén poligalogenoproizvodnyh.
1. Acetilén állíthatjuk elő magas hőmérsékletű repedés metán:
valamint hidrolízisével kalcium-karbid:
2. Az alkilezést az acetilén végezzük, konvertáló acetilén fémorganikus vegyületek:
CH≡C-Na + CH3 J → CH≡C-CH 3 + NaI
3. acetilén szénhidrogének képződnek hatására alkoholos lúggal digalogenoproizvodnye telített szénhidrogének, halogének egy vagy szomszédos szénatomokhoz;
Alapvető törvényei változás forráspont és szétolvad a homológ sorozat acetilén szénhidrogének hasonló a minták egy sor etilén és telített szénhidrogének.
A helyzet a hármas kötés a lánc nagyobb hatással forráspont. Így például, 1-butin-nél forr, 8,5 C-on és 2-butin - 27 ° C-on, majd mind a bután és butilének valamennyi szokásos körülmények között - gáz halmazállapotú anyagok.
A sűrűség és a törésmutató alkinek jelentősen magasabb, mint a alkén és több alkánok.
Acetilén-szénhidrogének az infravörös spektrumban a jellemző abszorpciós sáv a hármas kötés vegyértékrezgéseinek át 4,75-4,2 m (2100-2300 cm-1.
Annak vizsgálata során, kémiai tulajdonságait alkinek vizsgálni különösen a hármas kötést: képest alkének, alkinek valamivel kevésbé aktív elektrofil addíciós és aktívabb reakciókhoz nukleofilekkel (víz, alkoholátok, aminok). Ezek a tulajdonságok az acetilén csoportok magyarázható felépítését. Mindkét szénatomok acetilént SP-hibrid állapottal. Eközben a nagyobb aránya s-pályák a hibrid állapotban, az elektronok közelebb vannak a sejtmagba, és, következésképpen, a nehezebb ezeket az elektronokat vesz részt a kémiai átalakulás bevonásával elektrofilekkel. Másrészt, a szén-dioxid-sejtmagba acetilén sokkal könnyebben hozzáférhető a nukleofil reagens keresztül lineáris szerkezetű:
Ez a tényező is meghatározza jelentős savasság CH-terminális acetilén-csoport. Elektronpár C-H kötés a molekulában acetilén közelebb a mag, mint abban az esetben az etilén és a hidrogén atom több pozitívan polarizált.
Hidrogént adagolunk helyett a hármas kötés a jelenléte ugyanazon katalizátorok, mint az a hely, a kettős kötés:
Csatlakozási halogének (klór, bróm, jód), hogy alkinek elektrofil mechanizmus szintén egy lassabb sebességgel, mint az olefinek. Képződnek ezen digalogenoproizvodnye telítetlen izolálhatjuk a reakcióelegyből:
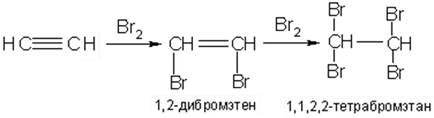
Csatlakozási alkinokra halogenidek keverékét kapjuk etilén és korlátozza monogalogenozameschennyh digalogenozameschennyh szénhidrogének:
Addíciós reakció a halogének és a hidrogén-halogenidek, hogy alkin átjutni a mechanizmusa elektrofil vagy gyök hozzáadásával. Amikor az elektrofil mellett Markovnyikov szabály figyelhető meg, egy gyökös mechanizmussal történik az ellenkező irányba való csatlakozás.
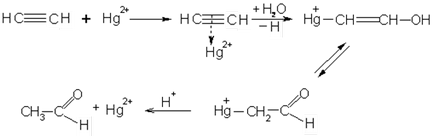
Alkinek könnyen csatlakozik a víz és a sav ellentétben alkének. Joining víz végezzük jelenlétében higany-szulfát - Kucherova reakciót. Az így kapott acetilén acetaldehid és homológjai a - ketonok
A reakciót acetilén vízzel használják az iparban előállítására acetaldehid. Egy lehetséges reakció mechanizmusa Kucherov:
Alkoholok kapcsolódnak alkinek jelenlétében alkoholátok. Ezzel a módszerrel, a vinil-éterek, acetálokat, valamint:
Joining alkoholok jelenlétében alkoholátok - ez egy tipikus reakció a nukleofil addíciós. A mechanizmus a következő: