periodikus törvény
Még a középkorban, vegyészek észrevette, hogy néhány, a kémiai elemek egymáshoz hasonló számos tulajdonságokat és kompozíciók vannak kialakítva őket. Fokozatosan, a teljes készlet elemek kiosztani természetes család. kombinálásával a kapcsolódó elemek. Ezek között voltak, például az alkálifém-család és a család halogének. A XIX század találtak több és több új törvényeket a elemek tulajdonságai, és vegyészek kezdett, hogy megpróbálja egyesíteni egyetlen rendszer egész sokasága ismert elemeket.
Természetes sor kémiai elemek, amelyekhez rendelt növelésével rendszám Z, a nagy tudós képes volt megszerezni az értékeket a atomsúlyainak az elemeknek, amelyek ebben a sorozatban is növelik. Gyakorisága alapján a megfigyelt tulajdonságok természetes számok, Mendeleev fogalmazott a periodikus törvény és befejezte a rendelés az elemek. Modern készítmény periodikus törvény a következő: „Properties of kémiai elemek és azok összetételét és a tulajdonságait a vegyületek a periodikus töltésétől függően a atommagok.”
A zseniális nyitó Mengyelejev, hogy a tudósok képesek voltak elkapni a természetes kapcsolata a rendszám és kémiai tulajdonságai, anélkül, hogy lehetőség lenne megmagyarázni, mivel semmi idején nem volt tisztában az atommag, vagy egy elektron héj, vagy vegyérték elektronok.
Így született meg a periódusos rendszer a kémiai elemek. kiterjedő és szervezi az összes elemet, kivétel nélkül. Van egy hatalmas számos lehetőség a grafikus kijelző a rendszer, de a legelterjedtebb változata a táblázatot. Mai alakját mutatja az alábbi ábra.
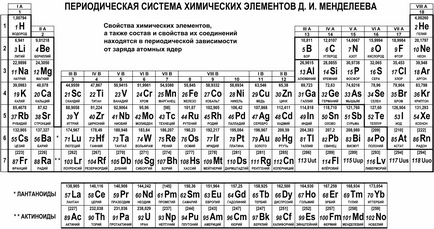
Természetes sor kémiai elemek a periódusos rendszerben található hét vízszintes sorokban, az úgynevezett időszakokat és vannak számozva 1-től 7 (lantanidák és az aktinidák tartozik a hatodik és a hetedik időszakban, illetve és amennyiben külön vonalak kényelmi okokból). Az első három szakaszban hívják kicsi. mert tartalmaz egy kis számú elemet (2, illetve 8); A pihenőidő említett nagy. mindegyiket egy nagy számú elemet (18 vagy 32).
Természetes családnak vannak elhelyezve függőleges oszlopokban az asztal - csoportok. Emellett a csoportok számozásának a számok 1-től 18, a kijelölési római számokkal I-VIII és a betűk A (fő) vagy B (oldalsó). Például, a család az alkálifémek (Li, Na, K, Rb, Cs, Fr) van a IA-csoport, és az úgynevezett érmék fémek (Cu, Ag, Au) - csoportban IB; család halogének (F, Cl, Br, I, At) csoportjába tartozik VIIA és a nemesgázok (He, Ne, Ar, Kr, Xe, Rn) csoportjába tartoznak VIIIA.
Érdekes tudni! Az első verzió az asztal elemeit tartalmazza fele az elemek száma, és néhány közülük kerültek másképp. A felfedezés új elemeket és a fejlesztési elképzelések a szerkezet az atomok és a periódusos rendszer finomított alakult ki, és ez a történet sok rejtélyek és felfedezéseket. Még most is a helyzet az egyes elemek a rendszer továbbra is meg kell adni: például a családok lantanidák és az aktinidák hagyományosan említett IIIB csoport lutetium (Lu) laurencium (LR), hanem közvetlenül IIIB oszlop helyett Lu és Lr hagyjuk rendre lantán (La ), és aktínium (Ac).
Csak egy fél évszázad felfedezése után a periodikus törvény tudósok képesek voltak, hogy fényt derítsen a belső atom készülék és magyarázza a periodicitás tulajdonságainak elemekkel. Fejlődésének köszönhetően az alapvető fizika, most már tudjuk, hogy az ok a periódusos törvény egy réteges szerkezete az elektron pályák atomok.
A természetes sor kémiai elemek egymás utáni növekedése töltés Z nucleus, és így az elektronok száma az atom. Így az elektron felhő képződött rétegeket melyek tele egymás után ezeket az elektronokat. Nyolc elektronok halmozódott fel a külső réteg (és az első réteg csak két), a következő réteg kezd kell tölteni, és a mára már a külső. Így a külső réteg lehet kitölteni script periodikusan megismétlődik. és a külső réteg vegyérték elektronok, és a kémiai tulajdonságai a vegyületek és összetétele is megismételjük periodikusan növekvő Z.
Amint kezd megtelni elektronokkal a következő réteg a periódusos táblázatban, akkor folytassa a következő sorban, azaz a következő időszakban. Ezért a száma az időszak, amelyben az elem megegyezik a rétegek száma elektron egy atom az elem, és egybeesik a számú külső elektronikus réteg. Például, az elemek az első időszak (H, He) elektronok egy első réteget; elemek a második időszakban (Li, Be, B, C, N, O, F, Ne) képeznek két réteg, amelynek egy külső második; és így tovább.
Az egyik csoport a elemeken, ahol az őszi, amelyben azonos számú vegyérték elektronok. Az elemek egy-vegyértékű csoportok csak azok az elektronok a külső réteg, és a számuk növekszik, egy-nyolc belül minden egyes időszakban (kivéve az első). Ezért, az A-szám csoportok (kijelölt római számokkal), ahol az elem egyenlő az elektronok száma per atom a külső réteg az elem. Az egyetlen kivétel ez alól hélium: annak atom csak két elektron a külső rétegben, de ez kerül egy csoport VIIIA, mivel a megtöltött külső réteg adja a tulajdonságait egy nemesgáz hélium.
Rendszerezése elemek Mengyelejev taszítja az első fokon a összetételét és tulajdonságait az egyszerű anyagok és vegyületek oxigén és hidrogén. Ezeket a vegyületeket a nagymértékben az jellemzi, a természet elemeivel, így gyakran nevezik a jellegzetes vegyületek. Ezek a hagyományos lehetnek oxidok, hidroxidok és hidrogén vegyületek. látható az elemek a harmadik időszakban a száma vegyérték elektronok befolyásolja a készítmény és a találmány szerinti vegyületek tulajdonságait (argon azok nem képeznek, és ezért nem szerepel a táblázatban):