A fluorozás jelentése fluoratom és nagyobb fém-fluoridok
A közvetlen hatás a fluort a szerves anyag vezet heves reakció kíséretében járványok és a robbanások. Ennek eredménye a hidrogén-fluorid és a bomlástermékek zheniya-szerves molekulák (szén tetrafluormetán). Ez az irány a reakció miatt magas exoterm, kiváló törési energia szén-szén kötést tartalmaz.
Több nyugodt reakciót hígítással fluor- (és gőzök szerves anyagok) inert gáz környezetben adatok, észlelő rész és kimenetre a kialakult hővezető rendszer a robbanás nagyon széles határok. Így egy higító gáz a gyakorlatban rendszerint nitrogén. Amikor rirovanii-fluoridot a folyékony fázisban lehet használni azok hatásának ellenálló fluor-Vey oldószerek (fluorozott szénhidrogének, alacsony tempera-ture- szén-tetraklorid). A leggyakoribb gázfázisú reakció, más, mint a pozitív hatása a hígítás nitrogén-csomagnak a hőfej (például rézdrót).
Mechanizmus fluorozási reakciók nagyon eltér klorittartalmú rirovaniya. Az ok nagyon gyenge elektrofil fluor-molekula, miáltal csak akkor fordulhat elő dikalno RA-lánc-reakció. Nem igényel külső iniciátort és lánc spontán keletkezik miatt köl-fluor-kölcsönhatás a szénhidrogén; további fejlesztése a lánc zajlik egy hagyományos módon:
Egy másik funkció a nagy aktivitás és a hozzá kapcsolódó kis szelektivitású fluorral annak szerves molekulák támadást. Így, ellentétben a klórozási, fluorozási reakció egyidejűleg végbemenjen helyettesítés és felül, és a helyére szinte azonos a valószínűsége különböző típusú víz-atomok, beleértve a fluorozott már kialakult. Ezen túlmenően, jelentős fejlesztési kap hasítási a C-C kötés; ilyen transzformációk korlátozódik mérséklésére a reakció körülmények között.
A fentiekben kifejtett okokból a fluorozási végezzük ipari-Ness elsősorban perftorproizvodnyh szénhidrogének (PFC-k), amelyek különböznek nagyon SZEZON Coy termikus és kémiai stabilitása. Ezek termékek a fluorozási közepes olajtartalmú frakciók használni, mint egy hőálló kenőolajok és hidraulikus folyadékok, és a vizes frakciókat pro-C7 -S10 - oldószerként.
Az iparban, nincs módja annak, hogy sok-hozamát.
A katalitikus fluorozást végezzük egy olyan berendezésben réz pelyhek, ezüsttel bevont réteg: a Appa táplált patkány fluor- és szénhidrogén nitrogénnel hígítva. A szerepe a réz miatt magas hővezető és fejlődik hő felhalmozódását. Ezüst látszólag ne-megy át a cselekvés a fluor AgF2. amely elég lágy ahhoz, fluorinates szénhidrogén. Azonban van egy közvetlen és inter-hatását az utóbbi fluoratom, ahol, a hozam viszonylag kicsi, 40 és 80-90%.
Metalloftoridny eljárás a legelterjedtebb. Ez alapján a használata nagyobb fém-fluorid (CoF3. MnF3), kölcsönhatásban áll a szénhidrogének egy viszonylag puha, és nem olyan magas hő. A hulladék só regenerálódik újra hatására fluorid:
Ez a teljes hő-rea CIÓ F2 GH, 460 kJ / mól, elosztja követően a két szakaszban, az, amely fogadja a szénhidrogén-stie tanítás egyetlen, amelynek a hatása mérsékelt hő. Következésképpen, a magasabb hozam terméket kapunk.
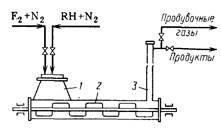
A reaktor (ábra. 53) egy Hori-tal acélcső amely lapátos keverővel sebességgel forgatjuk a
20 fordulat / perc. A cső töltse ki mintegy fele-Nena kobalt-fluorid. Bal oldali részén, ahol a for-gruzochny sraffozás kapott pár szerves reagenssel razbav lennye-5-10-szeres feleslegben nitrogén. A másik végén a tórusz rea képződött eltávolítjuk, ahol a kezdetben esnek kivezető csövet, ahol a csapdába esett részecskék felszabadulnak kobalt-fluoridot, és ezután irányítják a hűtés és elválasztás.
A reakciót, ameddig 50% kobalt-trifluorid nem alakulnak difluorid. Az elegy hőmérsékletét neodímium-Nakova mentén a cső hossza: 150-200 ° C bemeneti és 300-380 ° C-on a kimeneten. Ez annak a ténynek köszönhető, hogy a fluorozott szénhidrogén-up eléggé gyorsan, és hogy elkerüljék megsemmisítése a kívánt alacsony hőmérsékleten. Ugyanakkor a helyettesítés az atomok az elmúlt-pocakos bevételt jelentős nehézséggel, és erre a tre-BUET magasabb hőmérsékleten. Az optimális érintkeztetési idő 2-3 perc. Miután 50% kobalt-trifluorid fogyasztottak, a szénhidrogén bevezetését megállítjuk, és a reaktort nitrogénnel átöblítjük. Ezután regenerált kobalt-trifluorid, pro-fúj át 250 ° C-on szabad fluor nitrogénnel hígítva, a berendezést átöblítjük ismét nitrogénnel, hogy kiszorítsa a fluor maradékok, és a reakciót úgy indítjuk újra. Így a reaktor működését periodikus és áll két fő szakaszra (GSS-kormányzati reakció és regeneráció) és tisztítását két művelet. Ez - egy jelentős hátránya ennek a módszernek.
Elektrokémiai fluorozás kezdési időpont-Wiwa csak az utóbbi időben, de van számos előnye-társadalmak összehasonlítva azzal a módszerrel csak le. N-ness ez a következő: az elektrolízis vízmentes hidrogén-fluorid-kloridot (azzal a kiegészítéssel, fém-fluoridok, hogy betétek magasabb elektromos vezetőképesség) termelt az anódon azonnal reagál fluorral oldva vagy emulgeálva egy folyékony szerves anyag. Mivel az áramlás újra intézkedések a folyékony fázisban keverés közben elért jó hő-és van egy széles folyamatirányítási lehetőségeket. Ezért nem szükséges, hogy a korábban előállításához és tisztításához molekuláris fluort, amely még mindig termelt ipari elektrolízis. A legjobb eredményeket elektrokémiai fluorozás hozamok szintézisében perfluor-karbonsavak, éterek, észterek, aminok, szulfidok, és más vegyületek, amelyek oldódnak a folyékony hidrogén-fluorid.