Valcncy hidrogénatom (H), és példák a általános képletű
Általános információk a hidrogén-vegyérték
Hidrogén - színtelen gáz, egy szagtalan.
Alatti hőmérséklet -240 ° C (kritikus hőmérséklete hidrogén), akkor nyomás alatt cseppfolyósított. Ha elpárolgó a kapott folyékony, szilárd hidrogén képződik formájában átlátszó kristályok, amelyek olvadáspontja -259,2 ° C-on
Hidrogén - a legkönnyebb gáz, ez 14,5-szer könnyebb, mint a levegő; tömege 1 liter hidrogén-normál körülmények között 0,09, a hidrogén oldódik vízben nagyon kicsi, de egyes fémek, mint például a nikkel, Palade, platina, feloldjuk jelentős mennyiségben.
Hidrogén három izotópok: Protium H 1, H 2 vagy deutérium és a trícium D 3 H vagy T. Tömegük számok 1, 2 és 3. stabil Protium és a deutérium, trícium - radioaktív. A mag 1 H hidrogénatomok tartalmaz egy protont. Magok közé tartoznak a deutérium és a trícium, illetőleg, kivéve egyetlen proton és két neutron.
A hidrogén molekula két atom - H2.
Vegyérték hidrogénnel vegyületek
A nucleus hidrogénatom tartalmaz egy protont, és Egyetlen keringési pálya körül egy elektron mozog (ábra. 1).
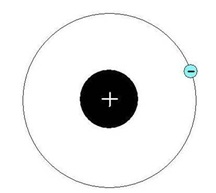
Ábra. 1. Szerkezet egy hidrogénatom.
Elektronikus képlete hidrogénatom alapállapotban a következő:
És az energia diagram:
A jelenléte egy párosítatlan elektront jelzi, hogy a hidrogén a jellemző vegyértéke azonos I. Ezt a tényt az is alátámasztja az a tény, hogy a hidrogén IA csoportjának a periódusos táblázat D. Mengyelejev, amint az jól ismert, a magasabb vegyértékét kémiai elem határozza meg a csoport szám, amelyben ez található. A vegyértéke hidrogén állandó minden vegyületek (BAH I 2. H I Cl, NaOH I. Ca (H I CO3) 2, stb)
Példák problémák megoldása
Ezek reagálnak egymással bináris hidrogénatom vegyületek? Indokolással ellátott választ. Az egyenletek a lehetséges reakciókat például hidrogénnel vegyületek az elemek a második és a harmadik időszak a periódusos rendszer.
Bináris hidrogénatom vegyületek elemek a második és harmadik időszakok kölcsönhatásba léphetnek egymással, bemutatva, hogy a sav-bázis és redox tulajdonságai. Például, egymással reagálni:- Az ammónia és a víz formájában ammónium-hidroxid (ammónia):
- Az ammónia és a hidrogén-klorid (hidrogén-fluorid), hogy készítsen-klorid (fluorid) ammónium:
- Foszfint és hidrogén-kloriddal a foszfónium-klorid:
Ezekben a reakciókban, az ammónia és a foszfin tulajdonságait mutatják egy bázis és víz, hidrogén-klorid és hidrogén-fluorid - ingatlan savak.
Redox reakciók fordulnak elő a kölcsönhatás a lítium és a nátrium-hidridek, vízzel, hidrogén-kloridot és hidrogén-szulfid:
Ezekben a reakciókban, fém-hidrideket, jár, mint a redukálószer, és a víz, hidrogén-klorid és a hidrogén-szulfid - a szerepe oxidálószerek.