T atom impulzus
Elektron egy atom mozog. Mivel ez a mozgás nem lineáris, egy elektron van egy perdület
Korai a múlt században, ha megteremti a Bohr atom modell feltételezte, hogy a stacionárius állapot egy atom csak azok, amelyekben a perdület egyenlő egész számú többszöröse a Planck-állandó h. osztva 2π. Ez lehetővé tette Bohr kiszámításához a megfigyelt hidrogén vonalai a spektrumban.
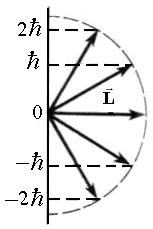
A perdület okozta mozgás a térben nevezik orbitális. Szerint a kvantumelmélet, a nagysága orbitális impulzusmomentum
ahol l - orbitális kvantum szám, amely feltételezi, hogy a értéke 0, 1, 2 így a pillanatban L. elektron lendületet, mint az energia kvantált. azaz Tart diszkrét értékek. Tól kvantumelmélet ez egy másik fontos következtetés: a vetítési lendülete elektron bármely adott irányban a térben z (például, az irányt a mágneses erővonalak vagy elektromos mező) szintén kvantálva a szabály:
Egy elektron mozog az atommag körül, jelentése egy elemi körkörös elektromos áram. A klasszikus elmélet elektromágneses jelenségek, zárt áram forrása a mágnesesség. A tapasztalat, az következik, hogy a mágneses hatás a zárt áramköri (aktuális hurok), meghatározzuk, hogy az ismert termék a jelenlegi ereje i áramköri területéhez S. Ez a termék az úgynevezett mágneses pillanatban. Mi jelöljük μ. μ = én. Azt találjuk, a kapcsolat mágneses pillanatot egy perdület L. Példaként, úgy a mozgás egy m tömegű részecske és töltés q kerülete mentén r sugarú a frekvenciával ν.
A mikrorészecskék kvantumelméletet vezet ugyanazt a kapcsolatot, és a mechanikai orbitális mágneses momentuma az elektron. Most q = e (e <0!) - заряд электрона, m - его масса).
A kísérleti adatok (a finom felbontását a spektrális vonalak, az eredmények a Stern-Gerlach - mondjuk erről később) azt mondta, hogy az elektron képes 1s (orbitális kvantum szám l = 0, és ezért, L = 0) van egy nem nulla perdület S. nem mozgásával kapcsolatos a részecskék egészének. Ez perdület spin (spin, az angol spin, forgatás). A bevezetés után a „spin” azt feltételezték, hogy az elektron lehet úgy, mint egy „búgócsiga”, és a háta - mint jellemző a forgatást.
Spin kvantumszámok az elektron s = 1/2 (ugyanazt az értéket a proton, neutron, és a részecskék száma). Quantum száma előrejelzések. Ie csak két nyúlványt.
Spin impulzusmomentum arányos a spin mágneses momentuma us
Az energia eloszlása az energiaszintet. A Pauli-elv
Ha a részecskék azonos azonos kvantum számokat, azok hullám funkció szimmetrikus részecskék átrendeződése. Ebből következik, hogy két azonos fermion, ugyanazt a rendszert nem lehet ugyanabban az állapotban, mint A fermionok, a hullámfüggvény kell antiszimmetrikus. Fermion - részecskék fél-egész lépben.
Pauli-elv: egy bizonyos állapotban nem lehet több, mint egy fermionos. Az elektron, ami azt jelenti, hogy egy állam adott kvantumszámok (N, L, m,) nem lehet több, mint egy elektron. A Pauli-elv segít megmagyarázni, miért az elektronok egy atom nem megy egyszerre az alapállapotba azonnali energiát. Alapján a Pauli-elv magyarázható a periódusos rendszerben.