Só (kémia)
Sók - anyag molekulákból áll, amelyek közé tartoznak olyan anionok (anion) kapcsolódik a kationok különböző eredetű (fématomok metallovidnuyu csoportok, például NH + 4 és így tovább ..). Sók, melyeket a semlegesítési reakció savak. vagy bázisok. Általában, a sók kristályos anyagok. A legegyszerűbb példa sók - nátrium-klorid. amelyek kémiai képlet - NaCl.
1. nevek
Számos módszer sókat képezni nevek. Egyszerűen hozzon létre a cím szerinti só savak, aminosavak nemzetközi nevek. Így a cím szerinti sót oxigén savak, amikor sav-formázó elemnek magasabb vegyértékű végződő meg. Például:
- KNO 3 - kálium-nitrát (kálium-szulfát)
- CaSO 4 - kalcium-szulfát (kalcium-szulfát)
- Na 3PO 4 - nátrium-foszfát (nátrium-foszfát)
- BACO 3 - bárium-karbonát (bárium-karbonát)
- Na 2 SiO 3 - Nátrium-szilikát (nátrium-szilikát), stb ...
Names anoxiás savas sók a végén vagy-id id. Például: MgCl2 - magnézium-klorid. KJ - kálium-jodid, nátrium-bromid - nátrium-bromid, Na 2 S - nátrium-szulfid, stb ...
Ha egy fém része a só mutat egy másik vegyérték és formák az azonos savmaradék több só, elismerésének kell számát jelzi a savas maradékok, a molekulában, sók, vagy a fém vegyértékét. Amikor egy vegyértékű-maradékot, majd általában azt mutatják, a számát a savas maradékok hozzáadásával anionját az előtag nevét a görög számokkal. Például: CuCl - réz-monoklorid, CuCl 2 - réz-diklorid, stb ...
Amikor a sav maradék a két-vagy háromértékű, majd jelzi a fém vegyértékével, jelezve annak a római szám a zárójelben a név után a fém. Például: Cu 2 SO 4 - réz-szulfát (I), CuSO 4 - réz-szulfát (II), Fe 2 (SO 4) 3 - vas-szulfát (III), stb ...
A neveket-sók hozzá előtag vagy hidro-dihidro-. Például: NaHSO 4 - nátrium-szulfát, NaH 2PO 4 - nátrium-dihidrogén-foszfát, CaHPO 4 - kalcium-foszfát, Ca (H 2PO 4) 2 - kalcium-dihidrogén-foszfát, stb ..
A nevét bázikus sók, amelyeket egy savas maradékot nevek és szavak hidroxid vagy dihidroxid. Például: AlOHSO 4 --szulfát-alumínium-hidroxid, az Al (OH) 2 CH 3 COO - acetát-alumínium-dihidroxid, Cu 2 (OH) 2 CO 3 - karbonát-dihidroxid réz (II), stb ...
2. Módszerek megszerzésének
1. A helyettesítési hidrogénatomok a molekulák a fématomok savak:
2. Amikor cseréje hidroxilcsoportok molekulák szárakat savas maradékok-molekulák. Ennek lényege reakció a csere a hidrogénatomok a molekula-molekulák nemesfémből atomok (azonos valószínűséggel a csere a hidroxilcsoportok a molekuláris alapjait a savas maradékok-molekulák), ezáltal egy sót és vizet (semlegesítési reakció):
3. A reakcióban az a bázisos oxidok:
4. Amikor reagáltatunk sav és amfoter oxidok:
5. A reakciót a savakat sóik:
6. A reakcióban a savakat egy fém:
7. A reakcióban a bázist savas oxidok:
8. A reakcióban a bázisok sói:
9. A reakcióban a sav az alapvető oxidok:
10. A reakciót sók:
11. Az együtt fémsók:
12. A képletű fém nemfém:
Vannak más sóinak előállítási eljárásait.
Nem minden ilyen módszerek, akkor fog semmilyen sót. A savaddíciós sókat szokásosan úgy állítjuk elő, a szokásos sót oldunk. Például:
Bázikus sókat úgy képezzük, gyakrabban, ha a só formát viszonylag kis mennyiségű alkálifém. Például:
3. Besorolás
Számos módja van sók besorolás:
- A sav, amely megfelel a sót (kloridot. Foszfátok. Nitrátok)
- Közepes Medium (normál) sók, savas sók, bázikus sók
3.1. Átlagos (normális) só
Ha az összes savas hidrogénatomját a molekulák savak kicserélt vagy helyébe fématomok vagy összes hidroxilcsoportja a molekulában alapján csere anionok-molekulák, az ilyen sókat azt mondják, hogy a normális, vagy közepes, vagy egyszerűen sók. Például,
Ennek alapján az elektrolitos disszociáció elméletének. sók úgynevezett összetett anyagok, amelyek vizes oldatban disszociál fémbe kationok és anionok a savas maradékok. Normál nincs más só kationok és anionok nem képezik más:
- KCI (aq) K + (aq) + Cl - (Aq)
- Al 2 (SO 4) 3 (aq) 2 Al 3 + (aq) + 3 SO 2 - 4 (Aq)
3.2. -sók
Ha csak egy része a savas hidrogénatomok-molekulák kicserélt vagy helyébe fématomok, az ilyen sókat nevezzük savas vagy gidrosolyamy. Például:
Savanyú sókat disszociál vizes oldatban és fém kationok, anionok és hidrogén kationok-maradékokat. Így, ha a sav só mind só, mivel képez disszociációs fémkationok és savas, mert mindkét forma és hidrogén kationok:
- NaHSO 4 (aq) Na + (aq) + H + (aq) + SO 2 - 4 (Aq)
- CaHPO 4 (aq) Ca 2 + (aq) + H + (aq) + PO 3-4 (Aq)
A hidrogén-ionok a savas só reagáltatva egy bázissal is lehet cserélni, hogy a fémionok képező normál sók és a víz:
3.3. bázikus sók
Ha csak egy része a hidroxilcsoportok a molekulák alapján csere anionok-molekulák, az ilyen sókat nevezzük alap:
Bázikus sók vizes oldatban disszociál fém kationok és anionok és a hidroxil-anionok. Így a bázikus só, ha a só egyrészt azért, mert ez képezi anionok upon disszociációja savas maradékok, és a szubsztrát, ezért alkotó hidroxid aniont:
- Cu (OH) Cl Cu 2 + (aq) + OH - (aq) + Cl - (Aq)
- Fe (OH) CO 3 Fe 3 + (aq) + OH - (aq) + CO 2 - 3 (aq)
Mindkét só vízben, gyakorlatilag nem oldódik, de oldódik annak része felett bomlik, egyenletek. Hidroxil ionokat bázikus sóból bázissal reagáltatva egy sav is lehet cserélni anionok alkotnak normál sók
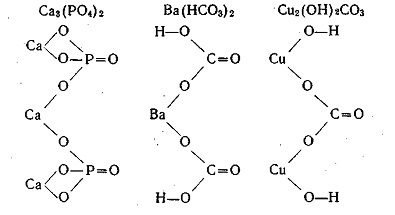
4. Szerkezeti képlet
ki képletek megfelelő savak és bázisok helyett a savas hidrogénatomok a fém atomok vagy hidroxilcsoport a bázisok a savas maradékok, a szerkezeti képletekben a sók kép. Például, mi adjuk a szerkezeti képletek a kalcium-foszfát, bárium-karbonát és a bázisos réz-karbonát:
5. tulajdonságok
Az összes só kristályos szilárd anyagok. Tekintettel a hő bizonyos só kellően stabil. Például: NaCl, KCI, Na 2SO 4, stb Ezeket a sókat melegítjük az olvadási hőmérsékleten, és még forrásban lévő, és nem bomlik. Mások sók nem stabilak, és bomlanak hevítésre olvadás nélkül. Például:
Szerint a vízben oldható sói vannak osztva könnyen oldódik, gyengén oldódik, és gyakorlatilag oldhatatlan. Ezek mind jól oldható sók salétromsav és acetát, valamint szinte az összes nátrium-, kálium- és ammóniumion. A lényegében oldhatatlan sók ezüst-klorid AgCl, bárium-szulfát BaSO4, minden szilikátok (kivéve NaSiO 3 és K 2 SiO 3), és mások.
A kémiai tulajdonságok határozzák meg sóik savakkal. alapítványok. és más fémsók.
1. A savakkal képezett sók kölcsönhatásba léphet csak akkor, ha a sav reagál erősebb, mint amelyből a só bekövetkezik. Például:
2. A sók kölcsönhatásba Meadows. akkor keletkezik, ha egy oldhatatlan bázis vagy egy oldhatatlan sót a reakcióban. Például:
3. Megoldások a sók kölcsönhatásba léphet a fém, amikor a fém az elektrokémiai sorban stressz maradt fém-só. Például:
4. Sok sók oldatban kölcsönhatásba léphet egymással, amikor az egyik a sók a reakció során képződött oldhatatlan. Például:
Ezt a szöveget tartalmazhat hibákat.