Lab 4
Célkitűzés: Annak megállapításához, a sav koncentrációja titrálási módszerrel.
Reagensek: desztillált víz, oldatok sósav sósavval (vagy HNO3) és nátrium-hidroxid nátrium-hidroxid (vagy kálium-hidroxid) koncentráció 0,1mol / l fenolftalein-oldatot (alkohol oldat) vagy metil-narancs.
Berendezés: Erlenmeyer lombikok 50-100 ml-es pipettával kapacitása 10 ml, egy 25 ml-es büretta, amelynek kapacitása 50-100 ml-es főzőpohárba, csepegtetővel a mutatók, üveg rudak, szűrőpapír.
Munkamódszerek
A műveletet kell egy nátrium-hidroxid-oldatot NaOH koncentrációja 0,1 mol / l.
Amint a 4.2. Készítsünk töltött büretta egy lúgos oldattal. Dial pipettával 10 ml-oldatot, és öntsük egy Erlenmeyer-lombikba, 100 ml; adja meg a 2-3 csepp fenolftalein. A lombikot fel a fehér papíron a bürettából.
Folytassuk a titrálás: lúgos oldatához büretta tartandó kis részletekben, mintegy 0,2 ml, a savas oldatban, amely folyamatosan kevertük.
Területe megoldás, ami esik lúg, festett rózsaszín eltűnőben keverés mellett. Amikor a rózsaszín oldatot elhalványul lassan kezdenek, hogy csökkentse a savas oldatot 0,1 ml, és így folytatják, amíg az oldat a lombikban egyetlen csepp nem fog gyenge, de megfelelően stabil színező oldatot. Ebben a titrálás vége.
Határozzuk meg a hangerőt a büretta szétválására alkáli-oldatot fordított semlegesítését teszi.
A titrálást még kétszer megismételjük, minden egyes alkalommal nulláról kezdve osztály bürettából.
Taken mennyiségű sav és lúg térfogata kapott értékeket táblázatban jegyeztük fel. 4.3.
kísérlet, és számítási eredmények
Kérdések az önálló elkészítése és ellenőrzése
1. Mi az titrálás? Hogy van ez a művelet?
2. Az úgynevezett standard oldat?
3. Mi az ekvivalencia pont, és hogyan van rögzítve?
4. Miért van az ekvivalencia pont van egy hirtelen megváltozása az indikátor színe?
5. Milyen mutatókat alkalmaznak a titrálási a megoldás?
6. Mi az átmeneti területet a mutató?
7. milyen környezetben színe megváltozik metilnarancsoldatot és fenolftalein?
8. A mi térfogataránya reaktáns oldatok azonos és különböző moláris koncentrációban?
Téma 5. kémiai kinetika és egyensúly alapvető meghatározások és kifejezések
Kémiai reakciók folytassa különböző sebességgel. Például, a semlegesítési reakció csaknem pillanatszerűen megy végbe, míg a reakció a hidrogén és oxigén, szobahőmérsékleten, és a katalizátor távollétében igen lassan halad. A tanítás a arányok kémiai reakciók nevezzük kémiai kinetika.
A reakció sebességét úgy határozzuk meg, koncentráció változását egységnyi idő. Annak a ténynek köszönhetően, hogy a koncentráció a kiindulási anyagok folyamatosan változtatjuk, a reakció sebességét fejezi ki származéka a koncentráció-idő
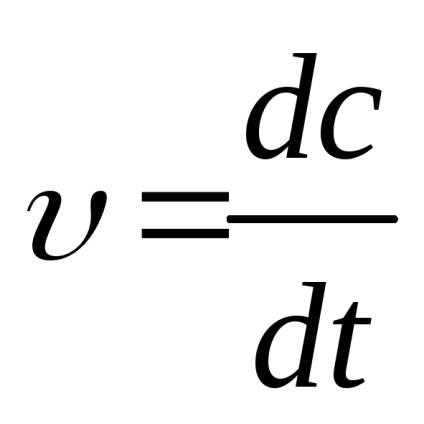
,
készüléket, a reakció sebessége mol / s.
Molekuláris reakciók a molekulák számát (részecskék) részt vesz az elemi esetén kémiai reakció. Ezen az alapon az összes reakció vannak osztva:
1) a monomolekuláris (a bomlási reakció, az izomerizációs);
2) a bimolekuláris (elszappanosítási reakció, észterképzés stb) .;
3) trimolekuláris (katalitikus elszappanosításával észterek és mások.).
Annak a valószínűsége, egyidejű ütközés több molekulák egy bizonyos típusú elhanyagolható; így a három-molekula reakciók ritkák.
Általában a kémiai reakció felírható a következőképpen:
Az ilyen matematikai jelölés rendszert kémiai reakció által kifejezett kapcsolatban
Ehhez a reakcióhoz, összhangban az alapelve a kémiai kinetika
ahol a CA és CB - a reaktánsok koncentrációja, mol / l; a és b - sztöchiometrikus együtthatók A és B anyagok; k - sebességi állandója egy kémiai reakció.
Amint az egyenlet (5.1), k = υ, ha CA = CB = 1 mol / l. Ennélfogva, a sebességi állandó számszerűen egyenlő az arány kémiai reakció a reagensek koncentrációkban egyenlő 1 mol / l. A számértékek a és b együtthatók az egyenletben a reakció sorrendje a reakció határozza meg az anyag és ezek összege - Általános eljárás a reakció.
Az, hogy a reagáltatást bármely pozitív (beleértve a 0 és a tört számok) értéket. Ez határozza meg a típusát kinetikai egyenlet lehetővé teszi, hogy kiszámítja a kémiai reakció sebességi állandója a reakció
ahol C0 - kezdeti koncentrációjának A anyag, mol / l; Ct - az anyag koncentrációja A jelenlegi mol / l; t - eltelt idő a reakció kezdetétől, amíg t. a.
Az, hogy a reakció lefutását a kísérleti adatok A koncentráció időbeli változását a reagensek.
A komplex reakció reverzibilis, soros, párhuzamos, és néhány más reakció.
Váltvaforgató reakciók azok, amelyekben együtt előrehaladását az előre reakciótermék képződését bevételek fordított szintézis reakció kiindulási anyagok:
Úgynevezett párhuzamos reakciókban, amelyekben a kiindulási anyag különböző módon, különböző sebességgel és állandó sebessége kialakulásának két vagy több termék:
Sequence nevezzük reakciót képződése kíséri és átalakítása intermedierek:
Váltvaforgató reakciók jellemzője az egyensúlyi állandó K. van meghatározva kapcsolatban
ahol K1 és K2 - állandó sebesség előre és hátra reakciókat.
Az egyensúlyi állandó bármilyen pozitív értéket. Ez számos tényezőtől függ (hőmérséklet, nyomás, a reagensek koncentrációja, stb), és határozza meg az elv a Le Chatelier dinamikus egyensúlyi - Brown. Ezen elv szerint, minden változás külső paraméter, amely meghatározza a rendszer állapotát, az egyensúlyi rendszer felé tolódott el az oldalán, a gyengítő hatása a hatását ez a paraméter. Így, ha a reakció a hőfelszabadulás, a hőmérséklet emelkedését eltolja az egyensúlyt képződése irányába toljuk el a kiindulási anyagok, és hűtés - az irányt képződésének reakciótermékek.
Ha a reakció egy mennyiségének növekedése anyag gáznemű termékek, a teljesebb reakció előre irányba fog járulni a nyomásesés, és a fordított - növekedését.
A legtöbb esetben az arány, és a reakció sebességi állandója a hőmérséklettől függ. Jellemzően magasabb hőmérsékleten a sebesség növekedésével. Ez a kapcsolat van kifejezve közelítőleg a következő tapasztalati szabály van't Hoff, amely szerint az arány a legtöbb kémiai reakciók a hőmérséklettel növekszik minden 10 fok (a hőmérséklet 100? C) növeli kettő-négy alkalommal. Matematikailag ez van írva a következő:
és ahol kT kT + 10 - állandó reakciósebesség hőmérséklet, T és T 10; - a hőmérséklet a reakció sebességi együttható ( = 2 - 4). Ezzel a szabály, meg tudjuk becsülni a változás a reakció sebességét kis hőmérséklet-tartományban (0-100? C):
Pontosabban, a függőség a reakció sebességét a hőmérséklet határozza meg az Arrhenius-egyenlet:
ahol R - az univerzális gázállandó, J (mol ∙ K); R = 8314; E - aktiválási energia, J / mól.
A aktiválási energiája egy kémiai reakció az úgynevezett minimális energia, ami kell reagáló molekulák leküzdeni az erők kölcsönös taszítása az ütközés.