Kiszámítása tartalmának karbonát ionok a vízben
A természetes vizek, a dinamikus egyensúly alakul ki a CO2-t. HCO 3 -. 2- CO3:
Az arány a szén-dioxid-formák függ a pH a víz (ábra. 4). at pH <4 вся углекислота находится в виде углекислого газа СО2 ; при рН = 8,4 в воде содержатся преимущественно ионы НСО3 – ; при рН> 10.5 túlsúlyban karbonát ionokat CO3 2-.
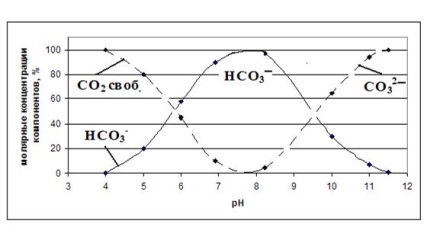
Ábra. 4. A pH hatása az arány a különböző formák
Példa megoldások az egyéni feladatok
Referencia feltételek: koncentrációjának meghatározása karbonát ion CO 3 2e a vizsgálati víz, ha a pH = 7,1 és [HCO3 -] = 6,8 meq / dm 3 (415 mg / dm 3).
1). A víz koncentrációja a hidrogén-ionok pH = 7,1 számítottuk a következő képlet szerint:
[H +] = 10 -pH = LG10 -7,1 = 7,94 • 10 -8 mol / dm 3
2). Szénsav disszociál ionokra lépéseket:
A karbonátion-(CO3 2-) köt egyenlet második disszociációs állandója szénsav, így a megoldásoknak, hogy használja a kifejezést K2:
9.3. egyéni feladatok
Feltételek hozzárendelések (táblázat 7.12.):
Határozzuk meg a koncentráció-karbonát-ion CO 3 2e a vizsgálati víz, ha a pH-értékek, és a koncentráció HCO3 - (lásd a táblázat 7.12 ..).
Numerikus - grafikai definíció paraméterek
Stabilizációs vízkezelés
Ionokkal a vízben HCO3 -. CO3 2- és CO2. kapcsolódik a szén-dioxid egyensúly:
A víz, amelyben tiszteletben az alapvető karbonátot egyensúlyi nevezzük stabil. Ez nem változtat a készítmény érintkezik a karbonátok, beton, széntartalmú védőfólia.
Amint az a egyensúlyi állandói a szén-dioxid-hidrogén-karbonát - ionok vannak oldatban csak a jelenlétében a szabad szén-dioxid:
Része a szabad szén-dioxid egyensúlyban van a szénhidrogén-ját szoba ionok, az úgynevezett egyensúlyi - [CO 2] ekv. Úgy tűnt, hogy vonják be karbonátot, és ezért nem lép kémiai reakciókat. A felesleges szabad szén-dioxid, ellentétben az egyensúlyi, aktív, és az úgynevezett agresszív. Azonban nem minden ez agresszív, egyik része a felesleges szabad szén-dioxid, ható kalcium-karbonát, átalakítja hidrogénatom és a másik része megy, hogy növelje a szén-dioxid mennyiségét, hogy tartsa az egyensúlyi oldatban mennyiségben az újonnan képződött hidrogén.
Víz alatti stabilitás megérteni a tulajdonát nem oldódnak kalcium-karbonát, és nem engedjük el a vízből. A zavar a stabilitás oka lehet a felesleg jelenlétében oldott szén-dioxid vagy az oxigén, az alacsony pH-jú, a túltelítettség a kalcium-karbonát vagy magnézium-hidroxid, a magas koncentrációja a kloridok vagy szulfátok. Instabil, mint a természetes víz és szennyvíz a kezelés után a szennyvíztisztító telepeken. Két változat lehetséges bizonytalanság a víz:
- Víz, amely feleslegben tartalmaz szabad szénsav fenti egyensúlyi, az úgynevezett agresszív. Való érintkezés hatására beton vagy karbonát, például filmek okoz a víz feloldjuk meszes cement és a beton komponensek:
- Víz tartalmazó szabad szénsav kisebb, mint az egyensúlyi mennyisége, azzal jellemezve, mint fogékony meszes lerakódásokat.
Stabilitás vízben két módszerrel határoztuk meg:
1) A vizsgálati módszer karbonátot (kísérleti módszer). Megtalálása a lúgosságot és a pH vizsgált víz érintkezés előtt és után a CaCO3 1 óra. víz stabilitás értékelése szempontjából a stabilitása (C) ivspomogatelnomu stabilitási index (Svsp.) táblázat szerinti. 10.15:
hol. rNiskh. - pH-ja a víz a természetes állapotban; rns -pH vizet a kalcium-karbonát telítési körülmények között. Stabilitás értékeltük a víz stabilitási index (Langelier J) táblázat szerint. 10.15.
Miután a víz a stabilitás értékelése (táblázat. 10.15) a labilitása vizet, hogy megvédje a fémcsövek, betonszerkezetek korrózió ellen, és képződése korrozív betétek rögös víz stabilizátor feldolgozás elvégzésére.
Értékelése stabilitása vízben
Rate stabilitását
Stabilitás Index (Langelier)