Fizikai és kémiai adszorpció - studopediya
Mint korábban megjegyeztük, noncompensation intermolekuláris erők a határfelületen képződését eredményezi a felszín közelében az erőtér. Ennek eredményeként, a felületi réteg kell koncentrálni komponenseket, csökkenti az energia rendszer egészére. Ez a jelenség a spontán növekedés (változás) a komponens koncentrációja a felületi réteg, mint az ömlesztett fázisú, úgynevezett adszorpciós. A hajtóerő az adszorpciós folyamat az a tendencia, a rendszer, hogy csökkentse a felületi feszültséget. Különböztesse gázadszorpciós egy szilárd adszorpciós oldott anyag a megoldás -, és a gázt a szilárd - oldatot. Meg kell jegyezni, hogy mivel a létezését a felesleges energia felület nem csak adszorpció, hanem felület nedvesítését, a szétterjedő folyadék felületén kapilláris jelenségek.
Az anyag, amelynek a felületére adszorpció következik be az úgynevezett adszorbens. amely lehet felszívódik a nagyáramú fázis -adsorbtivom. és a már felszívódott - adszorbát. A kvantitatív adszorpciójának i-edik komponense Gibbs, úgy definiáljuk, mint a felesleges mennyisége (mól) komponens egységnyi határfelületi területet, a leggyakrabban, mint a mol / m 2. A gyakorlatban, a felület nem mindig ismert, és az adszorpciós adatokat fejezzük száma adszorbeált gáz által egységnyi tömegű adszorbens, például mol / g. Ebből az következik, hogy az adszorpciós növekedésével nő finomsága a szilárd fázis az adszorbens, így a legfontosabb paraméter a fajlagos felület, azaz a terület egységnyi tömegre álló adszorpciós.
A fordított folyamat adszorpció, deszorpció hívást. Ha a gáz behatol a térfogatát az adszorbens, a folyamatot nevezik felszívódását. és ha a mechanizmus nem ismert, egy általános kifejezés - szorpciós.
Attól függően, hogy az erők közötti kölcsönhatás az adszorbeátum és adszorbens molekuláris felület megkülönböztetni fizikai adszorpció (fiziszorpció) és kémiai adszorpció (kemiszorpció). Gyakran két egymás utáni szakaszaiban egyetlen szorpciós folyamatot. A fizikai adszorpció és kemiszorpciós termodinamikailag megkülönböztethetetlenek, de különböző értékeivel jellemzett a differenciális moláris adszorpciós hő.
A fizikai adszorpciót okozza a nem-specifikus (generikus) intermolekuláris erők, lényegében a van der Waals erők. A megkülönböztető jellemzője fizikai adszorpció invertálható, amely által okozott alacsony értékei adszorpciós hő (4-40 kJ / mol vagy 1 - 10 kcal / mol). Természetüknél fogva, ezek a kölcsönhatások a típusú elektrosztatikus dipólus-dipólus kölcsönhatások, és tartalmazza:
a) diszperziós erők szinkron oszcillációk kölcsönható dipólusok - jellemző az adszorpciós nem-poláris molekuláknak (N2 H2 O2 és inert gázok keveréke) a nempoláros adszorbensek (például grafitból és szén); ..
b) indukció által keltett erők a kölcsönhatás a dipólus a többi indukált őket dipól - jellemző az adszorpciós apoláris molekulák (N2 O2 H2 és inert gázok keveréke) poláros adszorbenseket ionos (például SiO 2 Al2 O3, stb), és az adszorpció poláris .... molekulák (H2 O, NH3 és CO2, stb ...) egy nem poláros adszorbens, és a fémek;
c) orientációban keletkező erők egymáshoz viszonyított tájolása dipólusok kölcsönható - jellemző adszorpciós poláros molekulák (H2 O, CO 2, NH 3, stb) poláros adszorbenseket ionos (például SiO 2, stb.) .....
Szintén dipólus-dipólus, fizikai adszorpciós bevonásával ion-dipólus és kvadrupol kölcsönhatást.
Kemiszorpciós fordítva - visszafordíthatatlan és jellemzi a magas termikus hatások (40-400 kJ / mol és a 10. - 100 kcal / mol) okozott a felületi kémiai vegyületek egy vegyértékkötés. Kemiszorpciós néha képviseletében a kétdimenziós kémiai reakció, nem nyúlik túl a felületi réteg. Például, az oxigén kemiszorpció felületén a vas vagy alumínium fólia képződött reakciótermékek - oxid, amely megvédi a fémet a további oxidáció.
A fizikai és a kémiai adszorpció közbenső esetben létezik, például, adszorpciós miatt hidrogénkötés. A hidrogénkötés, ellentétben a Van der Waals erők, egy specifikus, azaz, helyi, hiszen kellő nonvalent reagáltatásával hidrogén proton-donor csoportok (OH, NH2. COOH) elektronegatív atom O, N, F, S, Cl, amelynek osztatlan elektronpárt (proton-akceptorok). Hidrogénkötések révén jön létre adszorpciója poláris molekulák (H2 O, CO 2. NH3, stb) A felszínen a adszorbensek a hidroxilcsoportokkal OH vagy oxigén (mint például a poharak, szilikagélek és zeolitok). A eloszlása elektronsűrűség a hidroxilcsoportok szilárdan össze van kapcsolva a szilícium-oxigén atomok a mag, oly módon, hogy a negatív töltés ott van tolva, hogy egy oxigénatom. Következésképpen, egy hidroxilcsoport OH jelentése egy elektromos dipól pozitív-negatív-töltés: hidrogénatom, egy kiterjesztett kifelé.
Ez a pozitív töltés, és biztosítja a kommunikációt a negatív töltések más molekulák, mint például a vízmolekulák. Ez annak köszönhető, hogy ezek a magas szorpciós tulajdonságokkal rendelkezik a H2 O szemüveget, szilikagélek (szilikagélek H2 SiO3) és zeolitok (kristályos alumínium alkáli- és alkáliföldfémek).
A fizikai adszorpció adszorbeált molekula megtartja szerkezetét anélkül, hogy elveszítené a személyazonosságát, t. E. A molekula és az adszorbens független alrendszerek kapcsolódó gyenge erők a Van der Waals erők. Mivel az erős intermolekuláris kötések kicsi, a fizikailag adszorbeált molekula lehet viszonylag könnyen eltávolítható a felületről.
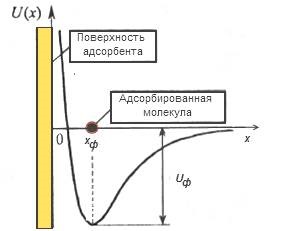
A 3. ábra az energia diagramja a folyamat fizikai adszorpció szilárd felületre
Az energia állapota az adszorbeált részecskék veszik, hogy képviselje a diagram U (x), amely bemutatja a függését az energia egy részecske interakció a szilárd felületre a távolság ezen a felületen. Egyensúlyi állapotban az energia diagramja megfelelő helyzetben a fizikai adszorpciós molekulák potenciális kutak mélysége UPH található a parttól a felületről KPH. Az érték Uf által meghatározott erő a molekula kölcsönhatásával felületi energia nevű fizikai adszorpció. Ez a folyamat mindig jön az energia felszabadítását hő formájában fiziszorpció:
ahol NA - Avogadro-szám.
Az adszorbeált molekula által visszatartott van der Waals-erők a potenciális is, teszi a termikus rezgések felületre merőleges. Thermal rezgések merőleges irányban a felület az elkötelezett molekulák potenciális jól vezet, hogy a legenergikusabb hagynak a felületen. átlagos idő # 964; életet molekulák adszorbeált függ fizikai adszorpció energiát. Ez határozza meg az arány kapott a diffúziós ugrik részecske a periodikus rács:
Itt, a sorrendben a molekulák közel időszak oszcilláció a potenciális jól által meghatározott rugalmassága ennek kapcsolódása a felületre. Mivel közel azonos különböző pár adszorpciós kommunikációs rugalmasság, úgy véljük,
10 -13 másodperc. Hő fizikai adszorpció tipikusan kisebb, mint 10 kcal / mol, míg az érték. képlettel számítjuk ki:, szobahőmérsékleten mérjük mikroszekundum, növekvő hőmérséklettel csökken.
A élettartama az adszorbeált molekulák egyike a fő meghatározó paramétereket időállandója a folyamat a fizikai adszorpció. A mennyiségi jellemző a folyamat töltési foka adszorpciós központok, definiált # 952; (t) = Na (t) / éj. ahol Na (t) - és az alkalmazott koncentrációtól adszorpciós központok (azaz adszorbeált molekulái ..) t időpontban, egy éj - teljes adszorpciós helyek számát az egységnyi területen. Adszorpciós nem az egész szilárd felületet, de csak az aktív centrumok.
Fizikai adszorpciós kezdődik és végződik szorpciós folyamat csak az inert gázok, amelyek molekulái, amelyek egy teljes elektron konfiguráció, csak sor a felületen intermolekuláris erők által a Van der Waals erők. Molekulák más gázokat és fém gőzök, amelynek fizikai adszorpciós lépést, amely képes további erősebb kölcsönhatás a felület által az erők a kémiai jellege és típusa kovalens heteropoláris kötések. Mivel az ilyen kommunikáció csak akkor lehetséges, atomi szinten, a pre-a fizikailag adszorbeált molekula disszociál atomok, amelyek atomközi kölcsönhatást, amely megalapozza a kemiszorpciós folyamatot.
Az energia diagramja a szorpciós folyamat, fizikai adszorpció és kemiszorpciós, mint az egymást követő lépéseket, a 4. ábrán látható A szaggatott görbe 1 írja le a folyamatot a fizikai adszorpció, és 2 görbe - a folyamat kémiai adszorpció két atom által termelt disszociációja a kiindulási molekula.
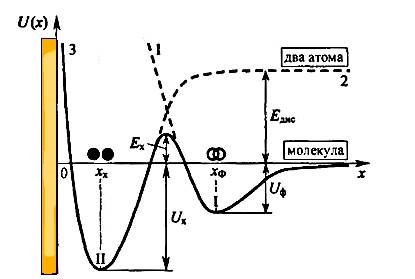
Ábra. 4. Az energia diagramja egymást követő fázisban a fizikai és kémiai adszorpció kétatomos molekulák egy szilárd felületre
A szilárd görbe leírja 3 kapott molekulát adszorpciós folyamat következik. Közeledik a felszíni molekula fizikailag adszorbeáljuk spontán, azaz. E. Rolls a potenciális kutak mélysége I Uf és található a parttól a felületről KPH. Későbbi áthaladását ilyen molekula a kemiszorpciós potenciálgödör mélysége Ux II két atom található a távolság x. Ez előírja, hogy legyőzik a potenciális akadály magasságát Ex, amely elválasztja a pit az I. és II. Ez csak molekulák elegendő energia-tartalma meghaladja a disszociációs energia Edis. Ex kemiszorpcióját magassága a potenciális akadályt az úgynevezett aktiválási energiája kemiszorpció folyamat. Ebben az értelemben, kemiszorpció, mint a diffúzió termikus folyamat. Ezért gyakran nevezik aktivált adszorpció.
Mivel az atomi erő 5-10-szer nagyobb, mint a Van der Waals erő, a hő Qx = Ux NA kémiai adszorpció eléri 40-100 kcal / mol. Ez biztosít egy életre részecskék az adszorbeált állapotban mért óra, nap vagy akár évekig is, attól függően, hogy a hőmérséklet.
Energia diagram lehetővé teszi számunkra, hogy megerősített kísérlet magyarázata hőmérsékletfüggése a töltési fok stacionárius adszorpciós helyek # 952; 0 minőségileg ábrán látható. 5, amely követi.
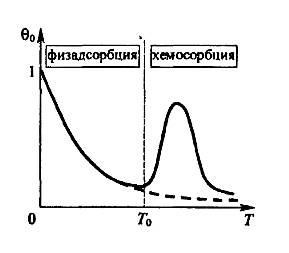
Ábra. 5. hőmérsékletfüggése a töltési fok stacionárius adszorpciós helyek
Alacsony hőmérsékleteken, az energia a termikus rezgések fizikailag adszorbeált molekulák nem elegendő azok elválasztása a felületről. Az eredmény egy egyrétegű adszorpció mértékű kitöltés # 952; 0 közel van egységét. A növekvő hőmérséklet mennyiség # 952; 0 esések a megnövekedett valószínűsége ejekciós molekulák kifelé a potenciális nos (lásd a 4. ábrát ..). Mivel a növekedési hőmérséklet hatásos versengő folyamat umklapp molekulát (formájában két atom) aktiválása útján gáton lyukba Ex II. Ezért, a megfelelően magas hőmérsékleten átalakítási folyamat a fizikailag adszorbeált molekulák kemiszorbeáljuk atomok uralkodóvá válik a folyamat felett hőkibocsátás a külső az első potenciális jól I. Ez magyarázza az emelkedés kiindulva hőmérsékleten T0 ábrán. 5. Mindazonáltal, még magasabb hőmérsékleteken kemiszorbeáljuk atomok olyan nagy energiája a termikus rezgések, amelyek által kibocsátott kifelé a potenciális kutak mélysége II (Ux + Ex), és egy összekötő molekulák elpárolog a felületről. Ennek eredményeként, van kemiszorpciót görbe maximuma (4. ábra). Jellege miatt termikusan aktivált kemiszorpciós eljárásban, eltérően a fizikai adszorpciós irreverzibilis: a hőmérséklet-változás a T1-T2, majd vissza a kiindulási hőmérséklet T1 változatlanul hagyja a mennyisége adszorbeált gáz.