Elektrokinetikai jelenségek - studopediya
Megkülönböztetni 4 fajta Elektrokinetikus jelenségek: elektroforézis, eiektroozrnózist, perkolálási potenciál (áram), a potenciális ülepítés (ülepítés).
Hatása alatt a külső elektromos mező megfigyelt két jelenség:
1. Az elmozdulás a diszpergált fázis a rögzített helyhez képesti diszperziós közeg - elektroforézissel.
2. A diszperziós közeg képest elmozdulnak az álló diszpergált fázis - elektroozmózis.
Phenomenon, fordított elektroforézis és elektroozmózis.
1. az esemény a potenciális különbség, amikor mozog a diszpergált fázis a rögzített helyhez képesti diszperziós közeg - a potenciálja ülepítés (ülepítés).
2. Az előfordulása egy potenciális különbség, amikor mozog a rögzített helyhez képesti diszperziós közeg a diszpergált fázis - a potenciális szivárgás.
Elektrokinetikus jelenségek oka a kialakulását a villamos kettős réteg, és ennek eredményeként, a jelenléte elektromos töltés, mint a részecskék a diszpergált fázis és a diszperziós közeg a részecskék.
Az érték elektroforézis elektroozmó
Az elektroforézist alkalmazunk a klinikai vizsgálatokban a sok betegség diagnózisát, a aminosavak elválasztását, nukleinsavak, antibiotikumok, enzimek, vérsejtek, tisztaság meghatározása céljából a fehérje készítmények Hatóanyagok beadására.
Szintén a gyógyászatban elektroforézis használják gyógyszerek adagolását. A bőrre tampont oldatával megnedvesítjük a hatóanyag, és a felső elektródák, amelyre alkalmazzuk alacsony, biztonságos a szervezet potenciális. Részecskék a gyógyszer hatására az elektromos mező a mozgó szövetekben.
Eiektroozrnózist használják víztelenítését különböző porózus anyagok. A nedves masszát helyezünk az elektródok között, és a víz alatti elektromos mező függően a szerkezet a EDL átkerül egyik elektróda és összegyűlik egy speciális gyűjtőedénybe.
Sebesség elektroforézissel (elektroforetikus aktivitás) számítjuk ki a Helmholtz-Smoluchowski egyenlet:
U - sebesség elektroforézis (elektroforetikus mobilitás)
# 949; - dielektromos állandója a közeg
# 958; - elektrokinetikus potenciál
H - a villamos tér intenzitása
# 951; - a közeg viszkozitása
Az elektromos térerősség arányával fejezzük ki a potenciális különbség, és az elektródák közötti távolság:
A stabilitás diszperz rendszerek
A diszperzió stabilitása érti, hogy képes tartani időt
- átlagos részecskeméret
- az egyenletes eloszlás a környezetben
megkülönböztetni kétféle stabilitás a diszpergált rendszerek - kinetikus (ülepítés) és az aggregált.
Kinetic (ülepítés) jellemzi azt, hogy a stabilitás a diszperz fázis részecskéi szuszpenzióban maradjanak, és nem a gravitáció hatására leülepednek erők.
Összesített stabilitás jellemzi azt, hogy a diszpergált fázis részecskéihez ellensúlyozza azok tapadását egymáshoz és így megőrzik mérete változatlan marad.
Kolloid oldatok stabilitásának közötti közbenső pozícióban durva rendszerek és a valódi oldatokat. Kolloid oldatokat jellemzően ülepedésre stabil rendszerek. esedékes
1. A kis részecskeméret
2. az intenzív Brown-mozgás
Az aggregálódásra stabilitás tényezők közé tartoznak a következők:
1. A jelenléte elektromos töltés részecskéket megakadályozza, hogy egymáshoz tapadjanak
2. Az a képesség, hogy oldják az diffúz ellenion réteget; termelt a részecske felületén védőréteg szolvatált ellenionok is megakadályozza azok összetapadását
3. adszorpciója a felületaktív felszínén anyagok (felületaktív anyagok); körül „hidrofil fejek” orientálják a dipólusok felületaktív képződött víz adszorpció eredményeképpen-szolvát rétegen tapadás megakadályozása. Ezt a jelenséget nevezik - „védelmi kolloid”
4. Az a közeg viszkozitása: minél nagyobb a viszkozitás, annál kisebb sebességgel, a részecskék mérete kisebb lehetőség ütközés és a szedimentáció.
Megsértése stabilitásának diszperz rendszerek előfordulásához vezet a koagulációs, valamint további ülepedését diszpergált részecskék.
A véralvadás folyamata koaleszcencia a kolloid részecskék alkotnak nagyobb aggregátumok elvesztése miatt a kolloid aggregációs stabilitás.
Véralvadási okozhat a különböző külső tényezők:
1. A kis mennyiségeinek hozzáadása elektrolit
2. a koncentráció a kolloid oldat
3. A hőmérséklet-változás
4. A hatás az ultrahang
5. A hatás az elektromágneses mező
6. rázás, keverés közben, stb
A biológiai rendszerek, a legnagyobb gyakorlati jelentőséggel a véralvadási elektrolitokat kolloid oldatait sejtek és a biológiai folyadékok érintkeznek elektrolitok.
Minden egyes elektrolitot kell a saját minimális koncentráció az úgynevezett koagulációs küszöbérték vagy koncentrációs küszöbérték (FBS).
A kölcsönös a küszöb a véralvadás, az úgynevezett véralvadási képesség:
A következő szabályok véralvadási elektrolitok:
1. véralvadási oka ionok, amelyek töltés jele ellentétes töltést pellet. Véralvadási pozitív töltésű szolok okozhat anionok negatív töltésű - kationok.
2. alvadási hatása az ionok, annál erősebb annál nagyobb a költség az ion - véralvadásgátló (Schulze-Hardy szabály)
liotróp a kationok
liotróp száma anionok
3. ionok azonos töltésű koaguláló képesség függ a sugár a szolvatált ion: minél nagyobb a sugara, annál kisebb a véralvadási képesség.
Következésképpen, az alkálifém-kationok felírható a következő liotróp sorozat:
A mechanizmusok a véralvadás szerepe elektrolitok, hogy:
1. A csökkentés a felületi töltés a szilárd fázis (a felületi töltés a sejtmagok) is előfordulhat, azaz által csökkentve a határfelületi (elektrotermodinamicheskogo) épület E.
2. vastagságát csökkentő is előfordulhat diffúziós réteg állandó felületi töltés magok.
Ebben a tekintetben a következőek alvadási elmélet:
1. adszorpció (kémiai) elmélet Freundlich
2. A fizikai elmélet koagulációs DLVO (B. V. Deryagina, Landau, E. Verwey, T. J. Overbeck.)
1. Az elmélet szerint a Freundlich koagulációs bekövetkezik az intézkedés alapján az elektrolit, amely kémiai reakcióba lép a potenciális meghatározó ionok, összekötő őket egy szilárd vegyület (például, fordítására kicsapása).
Így, amellett, hogy a pozitív töltésű ezüst-szulfid szol AgJ Kálium-jodid koaguláló K2 közötti S S 2- anionok és kationok a potenciális-Ag + reakció megy végbe: 2Ag + + S 2- → Ag2 S ↓. Ennek eredményeként, a határfelületi potenciális értéke esik, száma ellenionok szükséges, hogy kompenzálja a felelős a magok is csökken, és ennek következtében csökken, és a hidratációs héj körül ionokat, ami csomósodás a részecskék, azaz véralvadási. Ezen kívül, a kisebb mennyiségű határfelületi kapacitás és magában foglalja a csökkenés # 958; -potential, azaz csökkentése részecske töltés, ami egy csepp ellenállás, azaz véralvadási.
2. Összhangban a DLVO elmélet, alvadás az intézkedés alapján az elektrolit, amely nem lép kémiai reakcióba a PRI és nem változtatja meg a nukleáris töltés.
Ebben az esetben, a koagulációs fellépés mutatnak azok ionokat adunk elektrolit ellenionok, amelyek micelláris adatokat.
Növelése az elektrolit koncentrációja csökken a diffúziós réteg. Határfelületi potenciál azonban változatlan marad, de van egy csökkenés # 958; -potential.
Például: hozzátéve nitrát a szol, pozitív töltésű ezüst-jodid, ezüst-jodidot, amelyek micellák ellenionok NO3 -
Mivel a koncentráció a hozzáadott ionok NO3 - megkönnyítik a bevezetése a diffúz ellenion réteget a adszorbens réteg. Diffúziós réteg összenyomódik, és előfordulhat olyan állapotban, amelyben a diffúz réteg teljesen eltűnik, és a pellet elektroneutrális, azaz ez lesz az izoelektromos állapotban.
Izoelektromos állapotot nevezik az állam a kolloid részecskék, amelyben a zéta potenciál (# 958;) = 0, és amelyet az jellemez, hiánya irányított mozgás a szemcsék az elektromos mező.
Az aggregációs-állandósult érték a kolloid oldat # 958; -potential tartományban van 50-70 mV. A csökkenés # 958; -potential az elektrolit 25-30 mV a rendszerben van-e a külső változás (hologrammképződést színváltozás), mivel a véralvadás aránya nagyon alacsony, így ezt a lépést (I) az úgynevezett „látens” véralvadási (rizs).
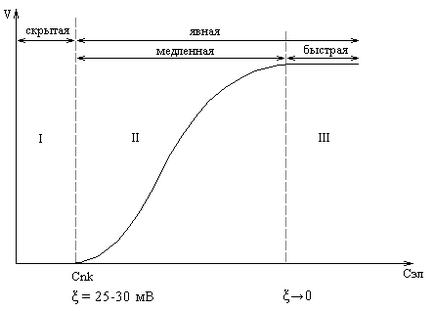
Ábra. Hatása elektrolit koncentráció a véralvadási sebesség
További elektrolit hozzáadásakor a (> CNN) kíséri zavarosodása az oldathoz, és kezdődik a „kifejezett” koaguláció. Kezdetben, a koagulációs sebesség gyorsan emelkedett (II lépés), majd állandó lesz, ha az érték # 958; -potential válik értéke 0, és jöjjön gyors koagulációs lépésben (III).
Koagulációt keverékei elektrolitok
Vannak 3 lehetséges kiviteli közötti kölcsönhatás elektrolitok: additív hatás, szinergizmus és antagonizmus.
Adalék - az az összeg, a kicsapó akció az ionok, guláiását.
Egy additív hatás figyelhető meg azokban az esetekben, amikor a elektrolitokat tartalmazó koaguláló ionok, nem reagálnak kémiailag egymással.
Például, különböző sók keveréke KCI, NaNO3 additív hatást eredményez tekintetében mind a negatív töltésű szolok (véralvadási oka K + Na +.), És a pozitív töltésű szolok (oka alvadási Cl -. NO3 -).
Antagonizmus - gyengíti a koaguláló, az elektrolit hatásának jelenlétében a másik.
Antagonizmus nyilvánul meg az esetben, ha egy kémiai reakció között elektrolitok koaguláló ionok vannak kötve oldhatatlan vegyület (csapadék), vagy egy tartós komplex, amely eddig nem koaguláló áramot.
Például, a koagulációs fellépés Pb2 + kationok a kedvezőtlen szolok legyengített jelenlétében NaCl, mint A reakció
Pb 2+ + 2Cl - = PbCl2 ↓
Szinergizmus - nyereséget a koaguláltató, az elektrolit hatásának jelenlétében egymással.
Szinergizmus akkor lehetséges, ha van egy kémiai kölcsönhatás, ami a kialakulása között, egy többszörös töltésű ion elektrolitok.
Például, FeCl3 és koagulációs cselekvési tiocianátot felé pozitív szolok (koaguláló ionok Cl -. CNS -) fokozódik, mert reakció történik
és a kialakulása ionok [Fe (CNS) 6] 3-. amelynek nagy kicsapó teljesítmény.
Az elektrolitok a gyógyászatban, meg kell vizsgálni annak lehetőségét, véralvadási biológiai mintákban, mint a bevezetése a különböző gyógyszerek a test injekcióval tudnia kell, nem számít, hogy ezen fokozók, hogy elkerüljék az esetleges véralvadási.
Csoportja esetében az úgynevezett alvadási kolloid oldatok heterogén tartalmú részecskék eltérő kémiai természete, nagyságát vagy jele a díjat.
Egy különös eset csoportja esetében a kölcsönös véralvadási - összeolvadásának ellentétes töltésű kolloid részecskéket. Amikor ez bekövetkezik, a teljesebb véralvadási, annál teljesen semlegesítjük a díjak a kolloid részecskék (szemcsék díjak).
Peptizálása úgynevezett fordított folyamat a véralvadás - iszap átalakítási folyamat által képzett koaguláció stabil kolloid oldatot.
Peptizálása gyakorlatban elvégzett két módja van:
1. a csapadék mosása tiszta oldószerrel (diszperziós közegben), ami kioldódását ionok, ami véralvadási.
2. Hozzáadjuk speciális elektrolit - peptizátoraként, ionok, melyek adszorbeálódnak a részecske felületén csökken ionos atmoszférában részecskék körül.
A szükséges feltételek peptizálása:
1. peptizálása csak frissen csapadék óta hosszú távú tárolás vezet koaguláltató részecskék kicsapása fokozatos tömörítés és annak elmozdulását a folyékony fázis szerkezetét.
2. Kis mennyiségű elektrolitot (különben bekövetkezik koaguláció)
3. Keverés megoldás
Kolloid elleni védelmet növeli az aggregált stabilitás liofil szolok által Hozzáadunk haditengerészet.
A mechanizmus a védőhatás, hogy a vizes kolloid oldat IUD amfifil molekulák felületén adszorbeálódott a kolloid részecskék vannak irányítva, hogy a hidrofób részükkel a diszpergált fázis részecskéinek, hidrofil - víz. Ennek eredményeként, a részecskék felületén válik borított liofil és kiegészítő szolvatáció héj.
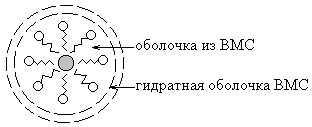
Tekintettel a vizes kolloid oldatok rendelkeznek jó védőhatást a vízben oldódó fehérjék. Így, vérfehérjék kicsapódásának gátlására izolálása és a koleszterin a falakon az erek, és a kalcium-sók.
Kolloid védelmet használnak előállítására stabil liofil szolok gyógyszerekként hasznosíthatók. Például, egy kolloid ezüst és Protargolum tartalmaznak erősen diszpergált fém ezüst, védett makromolekuláris vegyületek.