Az okok a periodicitás elemek tulajdonságai
Periodikusan változó tulajdonságok a bemutatott elemek a szekvenciában magyarázható elektronok töltés szintek és sublevels atomokban növekvő sorszáma az elem töltés és a atommag.
Mivel az elektronikus konfigurációs atomok elemek periodikusan változnak, illetve periodikusan változtatjuk, és a tulajdonságai elemek, amelyek által meghatározott az elektronikus szerkezete: méretei atomok teljesítmény jellemzőit, oxidációs-vosstanovitelnymim tulajdonságokkal. A fő elemei a kémiai tulajdonság atomjaik oxidáló vagy redukáló képességet, ami által meghatározott helyzetét az elem a PSE. Abban az időszakban, az elejétől a végéig a helyettesítő tevékenység attenuált atomok és növeli oxidáció, azaz. E. átmeneti atomok tulajdonságokkal jellemző fématomok a jellemző tulajdonságai nem fémek, elektronegatív atomok a növekedést. A csoporton belül a tárgyak (fő csoport) növekvő atommag terhelési összeg növeli az energia szintjét az atomok. Így, aktivitásának csökkentésére atomok csoportok növeli fentről lefelé, és oxidációs - csökken, és a nagysága csökken EO atomok.
Töltsük fel a reakciókat a molekuláris, teljes és rövidített ionos formában
Vizsgálat jegy száma 42
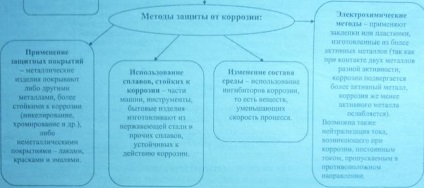
Módszerek védelmére fémek korrózió ellen.
Hidrolízis - cseréje közötti reakciót a só és a víz.
A képződött sót erős bázissal, és egy gyenge sav (lúgos közegben):
Na2CO3 + H2O = NaHCO3 + NaOH
A képződött sót egy gyenge bázissal és egy gyenge sav (semleges, gyengén savas, gyengén lúgos közegben). Az ilyen sók gyakran bomlik vízben teljes:
AL2S3 + 6H2O = 2AL (OH) 3 + 3H2S
A képződött sót egy gyenge bázissal és egy erős sav (savas):
CuCl2 + H2O = Cu (OH) CL + HCI
Ne hidrolizál képzett só erős savval és erős bázis.
3. Costavte teljes ionos és molekuláris egyenletet megfelelő rövid reakció egyenletek:
NiOH + + H + Þ Ni2 + + H2O
NiOH + + NO3 + H + + NO3 Ni2 + + 2 NO3 + H2O
NiOHNO3 + HNO3 Ni (NO3) 2 + H2O
Vizsgálat jegy száma 43
A fémbevonat által alkalmazott galvanizáló (galvanikus elektrolízis), merülő részeit egy olvadt fém borítás módszer és bádogozás (termikus szórás).
Galvanikus bevonás alkalmazásakor a védő és dekoratív bevonat különböző fém termékek (bevonat a króm, nikkel, ezüst), valamint korróziógátló bevonatok kötőelemek csövek (bevont cink, kadmium, réz).
A főbb rendelkezések az elektrolitos disszociáció elméletének S.Arreniusa.
1. Az elektrolit a vizes közegben (olvadt állapotban) hajlamosak esnek szét pozitív töltésű ionok (kationok) és negatív ionok (anionok). Tulajdonságok ionok drasztikusan eltérő semleges atomok az őket alkotó elemek. Ionok vizes oldatok hidratált (aqua komplexeket). Így, egy semleges nátrium-atom +11 Na 1s 2s 2 2 2p 6 3s 1 normál körülmények között könnyen ad a külső (3s 1) az elektron (oxidált). Nátrium hevesen reagál vízzel, savakkal, kémiailag aktív.
Ion (kation) nátrium +11 Na + 1s 2s 2 2 2p 6 nem adhatnak elektronokat (oxidálódik), nem reagál a vízzel.
2. A random (kaotikus) mozgását az ionokra oldatban egy elektromos mező válik irányított: a pozitív töltésű ionok (kationok) vándorolnak az elektróda, negatív töltésű (a katód), anionok és - hogy az anód. Ez magyarázza az ionos vezetőképességet vizes oldatok és az olvadt elektrolit.
Gidpatirovannye hidroxilcsoportok anionok mozog az anód, megfestettük semleges (lila) lakmuszpapírt kék.
Kationok oxónium H3 O +. mozog a katód, foltos lakmusz piros.
3. A folyamat a disszociációs elektrolitok a vizes közegben (olvadékok) reverzibilis:
3. Végezze hidrolízis egyenlet Be (NO3) 2. Rb2 S, BaCl2 molekuláris vagy ionos formában. Adjon pH.
Vizsgálat jegy № 44