Az áramkör felépítése az atom, példákkal
atomi szerkezetét reakcióvázlat
Mindenki tudja, hogy az atom áll, egy pozitív töltésű mag, amely koncentrálódik szinte minden annak tömegét. Belül a sejtmagok protonok és a neutronok, és körülötte kering a move negatív töltésű elektronok (1.).
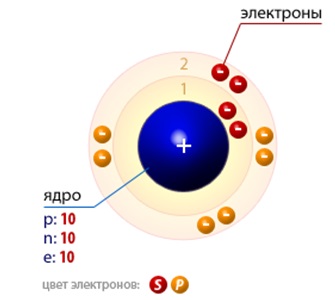
Ábra. 1. sematikus ábrázolása a szerkezet a neon atom.
A modell atomszerkezetre javasolta 1903-ban George. George. Thomson. Szerint a feltételezések atom áll, egy pozitív töltés egyenletesen elosztva az egész térfogata az atomok és elektronok oszcilláló ezen belül töltést.
Thomson hipotézist teszteltük, és igazoltuk E. Rutherford, aki végzett egy sor kísérletet a szóródása α-részecskék vékony fémlemezek és jelenteni. Kutatásai alapján, arra a következtetésre jutott, hogy szinte az összes tömege egy atom koncentrálódik igen kis mennyisége - a pozitív töltésű atommag. Körül a mag egy kellően nagy távolságban elektronok mozognak, és ezek száma olyan, hogy a teljes atom elektromosan semleges. A méretei a mag nagyon kicsi, mint a mérete egy atom egészének: az átmérője az atom - a sorrendben 10 -8 cm, és a mag átmérője - körülbelül 10 -13 - 10 -12 cm-es Egy ilyen modell az atomi szerkezet az úgynevezett nukleáris ..
Azonban annak ellenére, hogy a nagy áttörés a tanulmány szerkezete atom elmélet Ernest Rutherford nem ad választ a két kérdésre: az atom stabilitás és az helytelen következtetéseket a természete atomi spektrumok.
Jelentős mértékben hozzájárul a fejlesztési elképzelések a szerkezet az atom 1913 volt Niels Bohr, aki azt javasolta a kvantumelmélet, egyesítő nukleáris atom modell a kvantum elmélet a fény. Azt mutatta, hogy képes-e a fűtött test, a sugárzás lehet leírni kvantitatíve feltételezve, hogy a sugárzó energiát a kibocsátott és felszívódik a szervek nem folyamatosan, hanem diszkrét, azaz egyedi adagokban - kvantumokat.
A főbb rendelkezéseit Bohr atomszerkezetre rendszer
A főbb rendelkezések az elmélet, Bohr megadva, mivel minden táján
- Egy elektron lehet forgatni az atommag körül nem bárki, hanem csak bizonyos speciális pályán keringenek (álló).
- Mozgó mentén egy álló pályára, az elektron nem sugároznak elektromágneses energia.
- Sugárzás akkor jelentkezik, amikor egy hirtelen átmenetet elektron egyik helyhez kötött pályáról a másikra. Így kibocsátott vagy elnyelt foton az elektromágneses sugárzás, amelynek energiája egyenlő a különbség a végső energia az atom, és a kezdeti állapotok.
De Bohr szenvedett ellentmondás, így nem tudott válaszolni a kérdésre, hogy hol van az elektron van az átmenet folyamatának egyik pályáról a másikra.
Ezt a problémát úgy oldották csak a fejlődés egy új ága az elméleti fizika - quantum (wave) mechanika (tanításait Lui De Broglie és Schrödinger).
Példák problémák megoldása
A relatív atomsúlya volfrám egyenlő 183,2. Ismeretes, hogy a volfrám áll két izotópok: 183 W és 184 W Számítsuk móltörtje egyes izotópok a természetes volfrám.
Az izotópok - az atomok az azonos kémiai elem, amelynek eltérő a tömegszáma (a protonok száma megegyezik, de különböző - neutronok). Tegyük fel, az X számú volfrám atomok az izotóp 183 W minden száz természetes volfrám atomok, majd az atomok száma az izotóp 184 W lesz egyenlő (100-X). A tömege az izotóp 183 W atomok egyenlő 183h és 184 W - 184 × (100-X). Forma az egyenlet:
183h + 184 × (100-X) = 183,2 × 100%.
183h + 18.400-18.320 = 184h;